酸马乳是由鲜马乳经酵母菌和乳酸菌共同发酵而成的低酒精度(0.5%vol~2.5%vol)传统发酵乳制品[1-2],具有独特风味和一定的保健功能[3]。传统酸马乳通常采用自然发酵的方法制作而成,微生物种类繁多,其中作为优势菌的乳酸菌和酵母菌不仅赋予了酸马乳乳香与醇香交织融合的独特风味[4],还是其大部分益生特性的主要来源[5]。
酵母菌是酸马乳发酵中必不可少的菌种之一,对酸马乳的风味、质地和营养价值有着重要的促进作用[6]。酵母菌产生的酶可分解脂肪形成脂肪酸,并进一步与醇类物质发生酯化反应产生具有芳香味的酯类物质[7],还可与乳酸菌共同分解蛋白质产生大量的氨基酸[8],同时进行酒精发酵产生一定量的乙醇,这也是酸马乳杀口感及独特风味产生的重要原因[9]。随着人们对酸马乳功能特性和医疗价值的研究和挖掘,酸马乳产品的市场需求逐渐扩大,但由于其自然发酵的方式导致发酵菌种混杂、产品质量不可控以及其工艺难以标准化,限制了酸马乳产品的发展[10]。故而,挖掘性能优良、安全性高的发酵菌种,对酸马乳的产业化发展至关重要。
本研究以伊犁地区酸马乳为原料,通过稀释涂布法分离纯化、产气及产乙醇能力测定初筛、耐受性分析和安全性评价复筛,筛选出适用于发酵新疆酸马乳的优良酵母菌,通过分子生物学技术对其进行菌种鉴定,并将其应用于酸马乳发酵,验证其发酵性能,以期为新疆酸马乳中优良酵母资源挖掘和新疆酸马乳产品的开发及后续功能性研究提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
10份酸马乳样品:采集于新疆伊犁地区,均为当地牧民家手工自制而成;鲜马乳、自然发酵酸马乳引子:新疆乌鲁木齐市南山牧场;干酪乳杆菌(Lactobacillus casei)MLS5:新疆农业大学食品生物发酵与质量安全研究室菌种库保存;商业酿酒酵母(Saccharomyces cerevisiae)CVE-7:安琪股份有限公司。
1.1.2 试剂
药敏试验纸片(伊曲康唑、两性霉素B、氟康唑、伏立康唑):意大利Liofilchem公司;2,3,5-氯化三苯四氮唑(2,3,5-Triphenyltetrazolium chlorid,TTC)(分析纯):上海蓝季科技发展有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;盐酸、无水乙醇、乙酸钠(均为分析纯):天津市致远化学试剂有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基、YPD固体培养基、孟加拉红琼脂培养基:青岛高科技工业园海博生物科技有限公司;哥伦比亚血琼脂培养基:常德比克曼生物科技有限公司;MH琼脂培养基:广东中山百微生物科技有限公司。
TTC下层培养基:YPD固体培养基。TTC上层培养基:葡萄糖0.5 g/L,琼脂15.0 g/L,115 ℃高压蒸汽灭菌30 min后,冷却,加入TTC 0.5 g/L。
1.2 仪器与设备
LDZX-50KBS型立式高压灭菌锅:上海申安医疗器械厂;DHP-9082电热恒温培养箱、THZ-98AB恒温振荡器:上海一恒科学仪器有限公司;ECLIPSE E200MV R光学显微镜:日本尼康公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;CF1524R台式高速冷冻型离心机:北京科博赛尔科技有限公司;ABI-2720聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Thermo Fisher Scientific公司;K1140全自动凯氏定氮仪:海能未来技术集团股份有限公司;SX-70全自动索氏脂肪浸提仪:瑞士FOSS TECATOR公司。
1.3 方法
1.3.1 酵母菌株的分离纯化
取10 g酸马乳样品于90 mL无菌生理盐水中,28 ℃、130 r/min条件下富集培养24 h,采用生理盐水将富集液按10倍系列梯度稀释至10-7,取0.1 mL不同梯度的稀释液涂布于孟加拉红琼脂培养基,于28 ℃培养箱恒温培养48 h后,观察其菌落大小、颜色及边缘状态等。挑选不同形态的疑似酵母菌单菌落划线于YPD固体培养基上,28 ℃培养48 h,连续分离纯化3次以上至同一平皿上菌落形态一致。将纯化好的菌株保存于甘油管中,于-80 ℃超低温冰箱中保藏备用。
1.3.2 优良酵母菌株的初筛
产气能力测定:将甘油管中保存的分离酵母菌接种于YPD液体培养基中,28 ℃条件下培养24 h,相同条件下连续活化3代,将活化液按2%(V/V)的接种量接种到含有杜氏小管的YDP液体培养基中,28 ℃条件下恒温培养3 d,观察杜氏小管中产气量,根据杜氏小管中气体体积与发酵能力成正比判断其发酵性能[11]。
产乙醇能力测定:将活化后的菌株均匀涂布在TTC下层培养基上,28 ℃条件下培养2 d,覆盖一层TTC上层培养基,在28 ℃条件下继续恒温培养,观察其颜色变化,根据菌落颜色与产生的乙醇含量成正比分析其产乙醇能力[12]。
1.3.3 优良酵母菌菌株的复筛
(1)耐受性分析
参照焦媛媛等[13]的方法略作修改,将活化后的初筛酵母菌以2%(V/V)的接种量分别接种于不同pH值(4.5、4.0、3.5、3.0和2.5)、不同乙醇体积分数(0、2%、4%、6%和8%)的YPD液体培养基中,28 ℃条件下培养48 h,在波长600 nm处测定吸光度值,评价其耐酸和耐乙醇特性。将活化后的初筛酵母菌以2%(V/V)的接种量接种于YPD液体培养基中,分别于不同温度(30 ℃、35 ℃、40 ℃、45 ℃和50 ℃)条件下培养48 h后,在波长600 nm处测定吸光度值,评价其耐高温特性。
(2)安全性评价
溶血性试验:将活化后的初筛酵母菌划线于哥伦比亚血琼脂培养基上,倒置于28 ℃培养箱中培养48 h,观察菌落周围的培养基是否变为棕绿色(α溶血)或菌落周围是否出现明显透明圈(β溶血)。
药物敏感性试验:参照马文瑞等[14]的方法略作修改,将活化后的初筛酵母菌以2%(V/V)的接种量接种至YPD液体培养基,28 ℃、130 r/min条件下培养24 h后,取适量菌液稀释至菌体浓度为106 CFU/mL,取100 μL菌液涂布于MH琼脂培养基上,待菌液被完全吸收后,将4种药敏纸片(伊曲康唑、氟康唑、伏立康唑和两性霉素B)轻轻放置于培养基上,静置片刻,28 ℃倒置培养48 h后,测量并记录各药敏纸片抑菌圈直径,参照《CLSI M100 抗菌药物敏感性试验执行标准》进行结果判定。
1.3.4 优良酵母菌菌株生长特性分析
将活化后的筛选菌株按2%(V/V)的接种量接种于YPD液体培养基中,于28 ℃、130 r/min条件下恒温培养36 h,每隔2 h取适量菌液于波长600 nm处测定吸光度值(OD600 nm)值,以培养时间(x)为横坐标,以OD600 nm值(y)为纵坐标绘制生长曲线。
1.3.5 分子生物学鉴定
利用乙醇沉淀法提取酵母菌基因组DNA,以其为模板,采用引物ITS4(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS5(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增ITS rDNA基因序列。PCR扩增体系(50 μL):模板2 μL,2×Taq Mix 25 μL,引物ITS5(10 pmol/L)1 μL,引物ITS4(10 pmol/L)1 μL,双蒸水(ddH2O)21 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性10 s,53 ℃退火10 s,72 ℃延伸45 s,35个循环;72 ℃再延伸5 min。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测。将检测合格的PCR扩增产物送至北京博迈德基因技术有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源性较高的模式菌株的ITS rDNA基因序列,采用MEGA 11软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.6 优良酵母菌发酵酸马乳
将活化后的优良酵母菌按2%(V/V)的接种量接种于YPD液体培养基,28 ℃、130 r/min条件下培养24 h,将菌液在5 000 r/min条件下离心8 min,收集酵母菌细胞。用无菌生理盐水洗涤3次,洗涤完成后用磷酸盐缓冲液(phosphate buffer saline,PBS)重悬,稀释至活菌数达到107 CFU/mL。参考胜利[15]的酸马乳发酵工艺,将鲜马乳过滤、均质和巴氏杀菌后,分别接入2%(V/V)的优良酵母菌菌悬液、2%(V/V)商业酿酒酵母CVE-7和2%(V/V)自然发酵酸马乳引子,同时均加入3%(V/V)干酪乳杆菌MLS5,于32 ℃、130 r/min条件下发酵48 h后,放置于4 ℃冷藏24 h。
1.3.7 酸马乳理化指标的测定
pH的测定:在25 ℃条件下,用精密pH计测定pH值;酒精度的测定:采用GB/T 23546—2009《奶酒》中的酒精计法;脂肪含量的测定:采用GB 5009.6—2016《食品中脂肪的测定》中的盖勃法;蛋白质含量的测定:采用GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法;乳糖含量的测定:采用GB 5009.8—2023《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中的莱因-埃农氏法。
1.3.8 酸马乳的感官评价
由10位受过专业训练的人员组成感官评定小组,参考DB S15/013—2019《食品安全地方标准蒙古族传统乳制品策格(酸马奶)》对酸马乳的色泽、气味、滋味和组织状态进行感官评定,满分100分,具体评分标准见表1。
表1 酸马乳的感官评分标准
Table 1 Sensory evaluation standards of koumiss

项目 标准 评分/分色泽(25分)气味(25分)滋味(25分)组织状态(25分)色泽呈均匀乳白色或淡青色色泽呈淡黄色色泽呈灰白或其他异色有酸马乳特有香气香气较淡无香气或有异常气味酸味柔和,纯正爽口酸味偏重可接受非常酸涩乳体均匀,无乳清析出和异物乳体较均匀,乳清少量析出乳体不均匀,有大量乳清析出20~25 10~19 0~9 20~25 10~19 0~9 20~25 10~19 0~9 20~25 10~19 0~9
1.3.9 数据处理
每个试验重复3次,采用Excel 2016软件处理数据,结果用“平均值±标准差”表示,将所得数据用SPSS 27.0软件进行单因素方差分析(one way-ANOVA)及邓肯(Duncan)多重比较法分析,P<0.05表示差异显著。采用Origin 2021软件绘图。
2 结果与分析
2.1 酵母菌的分离及初筛
采用传统培养分离法从酸马乳样品中共分离纯化出20株酵母菌株,根据分离批次编号为TX1-1~TX1-9、TX2-1~TX2-5和TX3-1~TX3-6,其产气能力见表2。
表2 分离菌株的产气能力测定结果
Table 2 Gas production capacities test results of isolated strains

注:“-”表示管中不足1/3气体,“+”表示充满1/3气体,“++”表示充满2/3气体,“+++”表示管中充满气体。
菌株编号 产气能力 菌株编号 产气能力TX1-1 TX1-2 TX1-3 TX1-4 TX1-5 TX1-6 TX1-7 TX1-8 TX1-9 TX2-1++++++++++++++++++++++TX2-2 TX2-3 TX2-4 TX2-5 TX3-1 TX3-2 TX3-3 TX3-4 TX3-5 TX3-6++-+++++++++++++++++++++
由表2可知,菌株TX1-4、TX1-7、TX2-1、TX2-3和TX3-6的产气性能较差,故将其筛去。选择剩余15株具有较好产气能力的分离菌株进行产乙醇能力测定,结果见表3。根据菌株在TTC培养基上显色情况可初步判断菌株产乙醇能力,颜色越深表明菌株产乙醇能力越强[16]。由表3可知,菌株TX2-4和TX3-3在TTC培养基上无颜色变化,说明产乙醇能力较低或不产乙醇,菌株TX1-2、TX1-6、TX1-9、TX2-5、TX3-1和TX3-5在TTC培养基上显粉红色,说明产乙醇能力适中,其余菌株在TTC培养基上显深红色,说明产乙醇能力较高。有研究发现,产乙醇能力较低会影响酸马乳发酵后的风味,产乙醇能力过高又会破坏乳制品发酵品质及风味协调[17],故选择菌株TX1-2、TX1-6、TX1-9、TX2-5、TX3-1、TX3-5作为初筛菌株。
表3 分离菌株产乙醇能力测定结果
Table 3 Ethanol production capacities test results of isolated strains
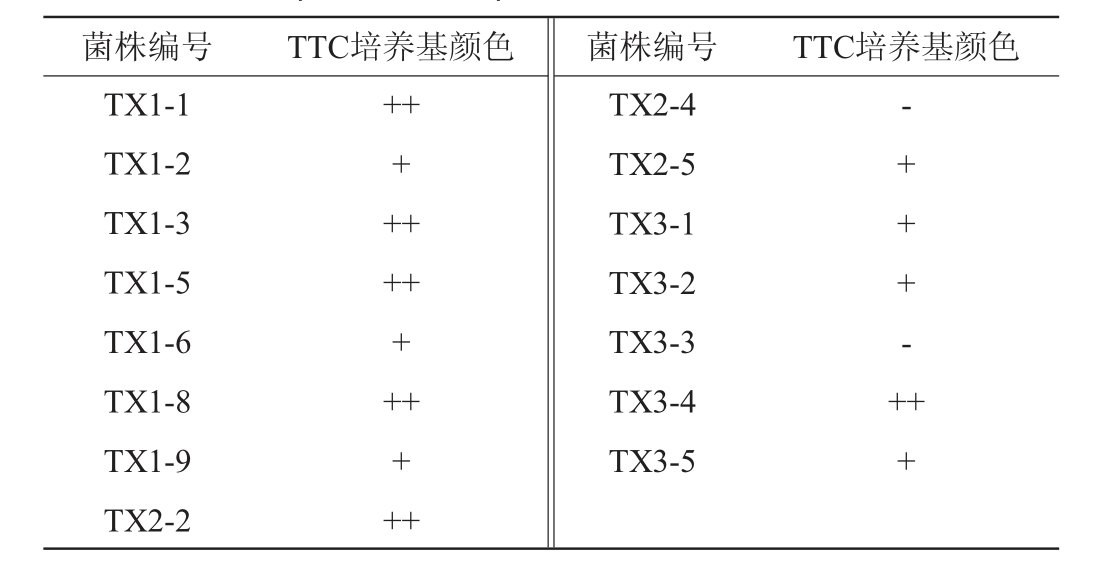
注:“-”表示颜色基本无变化,“+”表示呈粉红色,“++”表示呈深红色。
菌株编号 TTC培养基颜色 菌株编号 TTC培养基颜色TX1-1 TX1-2 TX1-3 TX1-5 TX1-6 TX1-8 TX1-9 TX2-2+++++++++++++TX2-4 TX2-5 TX3-1 TX3-2 TX3-3 TX3-4 TX3-5-+ + + - +++
2.2 初筛菌株耐受性分析
2.2.1 耐酸性试验
发酵马乳过程中会生成乳酸导致酸度升高,若发酵菌株无法适应酸性环境将会影响发酵效果[18],因此,耐酸性是筛选优良发酵菌株的重要评价指标。6株初筛菌株的耐酸性试验结果见图1。由图1可知,6株菌株均在pH 4.5的条件下生长活性最佳,随着pH的降低,生长活性均受到了不同程度的抑制,其中,菌株TX1-9和TX2-5的OD600 nm值下降最快,pH 3.5条件下OD600nm值分别下降为pH 4.5时的51%和54%。菌株TX1-2、TX1-6、TX3-1、TX3-5在pH值为3.0条件下仍保持较高的生长活性。pH2.5时,6株酵母菌生长活性均受到较大抑制但仍具有一定活性,菌株TX1-9的生长活性最低,菌株TX1-6和TX3-5的生长活性相对较好。

图1 不同酵母菌菌株的耐酸性试验结果
Fig.1 Acid resistance tests results of different yeast strains
不同小写字母表示相同条件下不同菌株的OD600 nm值存在显著差异(P<0.05)。下同。
2.2.2 耐高温试验
酸马乳发酵温度通常高于酵母菌最适培养温度[19],因此,酵母菌是否具有耐高温性是能否适用于马乳发酵的重要指标之一。6株初筛菌株的耐高温性试验结果见图2。由图2可知,培养温度为30 ℃时,6株酵母菌菌株的生长活性最佳,随着培养温度的升高,不同菌株的生长活性均受到不同程度抑制。其中,菌株TX1-6受温度影响较大,培养温度为40 ℃时的OD600 nm值相较30 ℃时降低了66%,但其在45 ℃仍具有一定生长活性。菌株TX3-1在40 ℃时仍保持较高生长活性,但培养温度达到45 ℃时,OD600 nm值降至0.09。当培养温度达到50 ℃时,菌株TX1-9仍保持一定的生长活性,其他菌株几乎不生长。
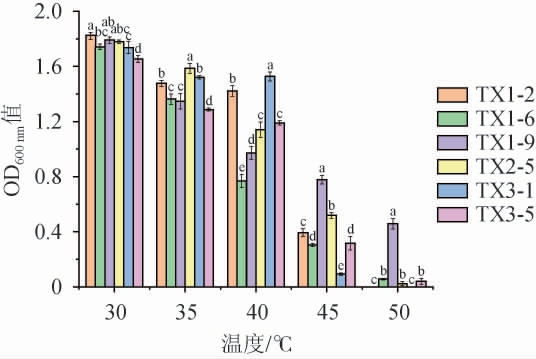
图2 不同酵母菌菌株的高温耐受性试验结果
Fig.2 High temperature tolerance tests results of different yeast strains
2.2.3 耐乙醇性能试验
随着酵母菌在马乳中生长会消耗底物产生乙醇,一定量的乙醇会影响微生物活性,从而影响发酵进程[20],因此,耐乙醇特性是筛选酸马乳优良发酵剂的重要指标之一。6株初筛菌株的乙醇耐受性试验结果见图3。由图3可知,6株酵母菌菌株的生长活性均随乙醇体积分数的增加受到不同程度的抑制。当乙醇体积分数为2%时,菌株TX1-9和TX2-5生长活性相较其他菌株降低明显。当乙醇体积分数上升至4%时,菌株TX3-1和TX3-5的生长活性开始下降明显。乙醇体积分数为6%时,菌株TX1-9、TX2-5、TX3-1和TX3-5的生长活性均受到严重抑制,仅菌株TX1-2和TX1-6生长活性良好。在乙醇体积分数为8%时,菌株TX1-9、TX2-5、TX3-1、TX3-5几乎不生长,菌株TX1-2相比不添加乙醇时生长活性降低了88%,但菌株TX1-6的生长活性仅降低了28%。
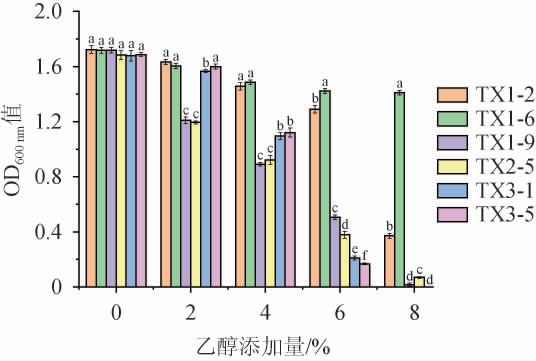
图3 不同酵母菌株的乙醇耐受性试验结果
Fig.3 Ethanol tolerance tests results of different yeast strains
综上所述,6株酵母菌均可耐受pH 3.0、温度45 ℃和乙醇体积分数6%,能适应酸马乳发酵环境。其中,菌株TX1-6的耐酸性(pH 2.5)和耐乙醇(8%)能力最佳,菌株TX1-9耐高温(50 ℃)能力最佳,耐酸性相对较差,可进一步探究其耐受机理。
2.3 初筛菌株体外安全性评价
2.3.1 溶血性试验
有研究发现,部分微生物会产生溶血素,对血细胞、核细胞及血小板造成损伤,影响机体健康[21]。因此,考察6株初筛菌株的溶血性,结果表明,6株酵母菌菌株在哥伦比亚血琼脂培养基上均未出现α型溶血和β型溶血,均不具有溶血性。
2.3.2 药物敏感性分析
微生物携带的耐药基因可通过不同机制传播,从而对人体健康存在潜在风险[22]。菌株耐药性是食品卫生安全的一大隐患,因此,药敏性分析尤为重要。三唑类抗生素是最常见的一类抗真菌药物(氟康唑、伊曲康唑、伏立康唑),其可抑制细胞色素P450的活性,进而抑制细胞膜上的麦角固醇,导致真菌死亡[23]。两性霉素B可抑制真菌的生长,作用机理是通过结合细胞膜上的固醇类物质从而改变真菌细胞膜的离子通透性[24]。本研究选择以上4种常见抗真菌药物考察6株初筛酵母菌菌株的药敏性,结果见表4。由表4可知,菌株TX1-2、TX1-6和TX3-1对4种药物均具有一定敏感性,而菌株TX1-9对两性霉素B耐受,菌株TX2-5对氟康唑耐受,菌株TX3-5对两性霉素B、氟康唑和伊曲康唑均耐受。结果判读为耐受可能是由于菌株对药物有剂量依赖性[25],不能直接证明其携带抗药基因,试验结果仅作为筛选参考,是否携带抗药基因以及抗药基因是否表达还需要进一步分子生物学研究验证。
表4 不同酵母菌菌株的药物敏感性判定结果
Table 4 Evaluation results of drug sensitivity of different yeast strains
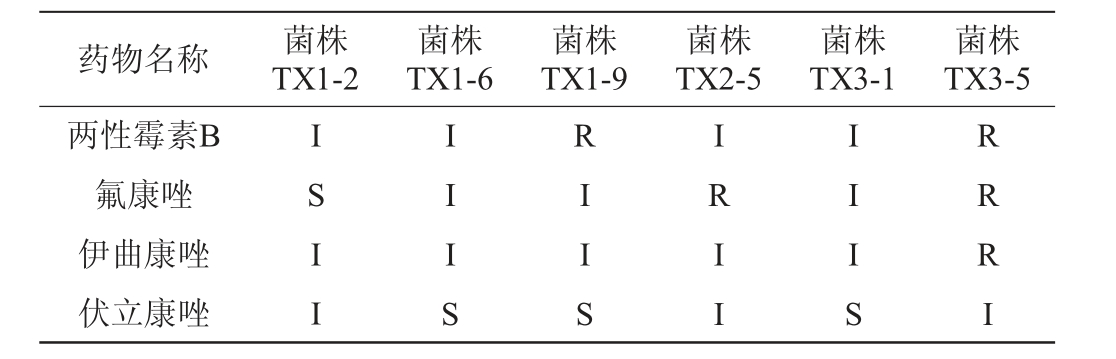
注:“S”表示高度敏感;“I”表示中介敏感;“R”表示耐受。
药物名称 菌株TX1-2菌株TX1-6菌株TX1-9菌株TX2-5菌株TX3-1菌株TX3-5两性霉素B氟康唑伊曲康唑伏立康唑I S I I I I I S R I I S I R I I I I I S RRRI
综上所述,6株酵母菌均不具有溶血性,但菌株TX1-9、TX2-5和TX3-5对抗真菌药物具有耐受性,因此,选择体外安全性良好的酵母菌TX1-2、TX1-6和TX3-1作为优良菌株。
2.4 优良酵母菌菌株的生长曲线
菌液的光密度值与微生物细胞数呈正相关,根据吸光度值的变化可反映出菌株数量和所处生长阶段。微生物的生长通常包含4个阶段,分别为延滞期、对数期、稳定期以及衰亡期[26]。3株优良酵母菌菌株的生长曲线见图4。
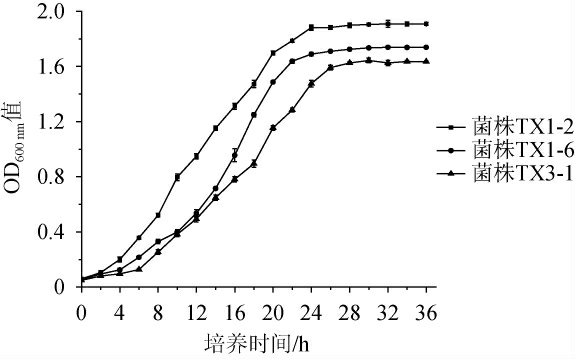
图4 3株优良酵母菌菌株的生长曲线
Fig.4 Growth curves of 3 superior yeast strains
由图4可知,3株优良酵母菌菌株的生长曲线均符合微生物生长趋势。菌株TX1-2和TX1-6在培养0~4 h时生长缓慢,菌株TX3-1在培养0~6 h期间生长缓慢,说明该时间段为酵母菌菌株的延滞期。菌株TX1-2在培养4~24 h时生长速率最快,处于对数生长期,同理,菌株TX1-6的对数生长期为4~24 h,菌株TX3-1的对数生长期为6~26 h,并均在对数生长期结束后进入稳定期。
2.5 优良酵母菌菌株的分子生物学鉴定
基于ITS rDNA基因序列构建3株优良酵母菌菌株的系统发育树,结果见图5。由图5可知,菌株TX1-2、TX1-6和TX3-1分别与达文波特星形酵母(Starmerella davenportii)(NR 155815.1)、酿酒酵母(Saccharomyces cerevisiae)(NR 111007.1)、马克斯克鲁维酵母(Kluyveromyces marxianus)(NR 111251.1)聚于一支,亲缘关系最近,因此,鉴定菌株TX1-2、TX1-6和TX3-1分别为达文波特星形酵母(Starmerella davenportii)、酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)。

图5 基于ITS rDNA基因序列3株优良酵母菌菌株的系统发育树
Fig.5 Phylogenetic tree of 3 superior yeast strains based on ITS rDNA gene sequences
2.6 优良酵母菌在发酵酸马乳中的应用
2.6.1 酸马乳理化指标的测定
在相同工艺条件下,分别采用3株优良酵母菌、商业酿酒酵母菌CVE-7和自然发酵酸马乳引子发酵制备酸马乳,测定其理化指标,结果见表5。
表5 鲜马乳及不同酸马乳的理化指标测定结果
Table 5 Physicochemical indexes determination results of fresh mare milk and different koumiss
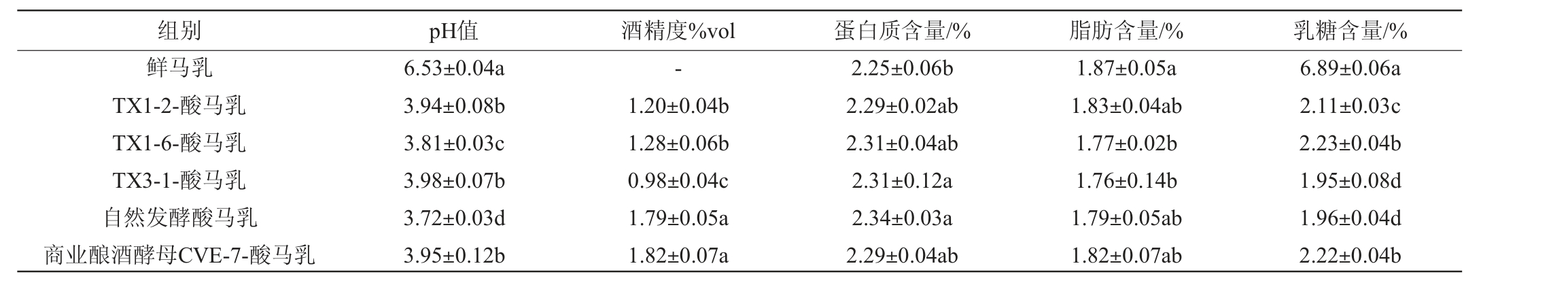
注:“-”表示未检出,同列不同字母表示差异显著(P<0.05)。
组别 pH值 酒精度%vol 蛋白质含量/% 脂肪含量/% 乳糖含量/%鲜马乳TX1-2-酸马乳TX1-6-酸马乳TX3-1-酸马乳自然发酵酸马乳商业酿酒酵母CVE-7-酸马乳6.53±0.04a 3.94±0.08b 3.81±0.03c 3.98±0.07b 3.72±0.03d 3.95±0.12b-1.20±0.04b 1.28±0.06b 0.98±0.04c 1.79±0.05a 1.82±0.07a 2.25±0.06b 2.29±0.02ab 2.31±0.04ab 2.31±0.12a 2.34±0.03a 2.29±0.04ab 1.87±0.05a 1.83±0.04ab 1.77±0.02b 1.76±0.14b 1.79±0.05ab 1.82±0.07ab 6.89±0.06a 2.11±0.03c 2.23±0.04b 1.95±0.08d 1.96±0.04d 2.22±0.04b
由表5可知,与鲜马乳比较,酸马乳的pH值及乳糖含量显著下降(P<0.05),蛋白质含量及脂肪含量相近,酒精度上升。不同组酸马乳的pH值为3.7~4.0,蛋白质含量为2.29%~2.34%,脂肪含量为1.76%~1.83%,乳糖含量为1.95%~2.42%,酒精度为0.98%vol~1.82%vol。与自然发酵酸马乳和商业酿酒酵母CVE-7发酵酸马乳相比,这3株优良酵母菌发酵酸马乳的蛋白质和脂肪含量差异不显著(P>0.05),酒精度显著降低(P<0.05),pH值和乳糖含量存在一定差异,可能是由于不同发酵菌株对马乳中营养物质利用率存在差异,但其理化指标均符合DBS15/013—2019《食品安全地方标准蒙古族传统乳制品策格(酸马奶)》要求。结果表明,3株优良酵母菌发酵马乳性能较好,产品质量较高,适用于酸马乳发酵工艺。
2.6.2 酸马乳的感官评价
不同菌株发酵酸马乳的感官评分见图6。
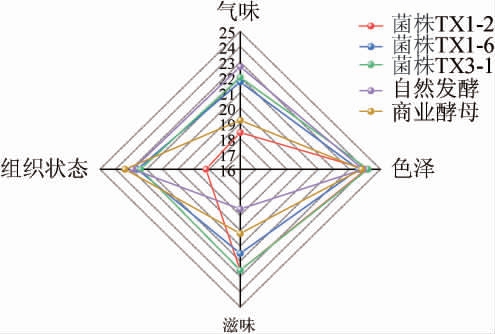
图6 不同菌株发酵酸马乳样品的感官评分雷达图
Fig.6 Sensory score radar map of koumiss fermented by different strains
由图6可知,5组酸马乳在色泽上基本无较大差异,均为乳白色,而气味、滋味和组织状态存在一定差异。其中,菌株TX1-2发酵酸马乳酸度适中爽口,但香气较淡且有少量乳清分离。自然发酵酸马乳香气浓郁且丰富,质地均匀,但口感偏酸。商业酿酒酵母CVE-7发酵酸马乳质地均匀,但香气不协调酒香偏重,口感微酸偏淡。菌株TX1-6发酵酸马乳质地均匀,香气协调,酸度适中口感顺滑。菌株TX3-1发酵酸马乳质地均匀,有浓郁乳香和乳酸味,酸度适宜口感柔和。综上,菌株TX3-1发酵酸马乳的综合感官评分最佳(91.20分),菌株TX1-6发酵酸马乳的综合感官评分次之(89.40分),二者均高于自然发酵酸马乳(88.10分)及商业酿酒酵母CVE-7发酵酸马乳(86.60分),菌株TX1-2发酵酸马乳的感官评分(83.30)最低。因此,可得所筛3株优良酵母菌中菌株TX1-6和TX3-1更具有发酵酸马乳的潜能。
3 结论
本研究采用稀释涂布法从伊犁地区10份传统发酵酸马乳样品中分离得到20株酵母菌菌株,通过产气、产乙醇能力、耐受性分析、溶血性试验及药物敏感性试验从中筛选出3株优良酵母菌菌株,编号分别为TX1-2、TX1-6、TX3-1,均具有较好的耐受性,可耐受pH 3.0、高温45 ℃及乙醇体积分数6%,且均不具有溶血性,对4种抗真菌药物氟康唑、伊曲康唑、伏立康唑及两性霉素B无耐药性。经分子生物学鉴定,菌株TX1-2、TX1-6和TX3-1分别为达文波特星形酵母(Starmerella davenportii)、酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)。将其应用于酸马乳发酵试验,结果发现,与商业酿酒酵母CVE-7和自然发酵酸马乳相比,3株优良酵母菌发酵酸马乳的蛋白质、脂肪含量差异不显著(P>0.05),pH值及乳糖含量存在一定差异,酒精度显著下降(P<0.05),理化指标均符合DB S15/013—2019《食品安全地方标准蒙古族传统乳制品策格(酸马奶)》要求。其中,菌株TX1-6和TX3-1发酵酸马乳的感官评分较高,分别为89.40分、91.20分,表明菌株TX1-6和TX3-1具有用于发酵新疆酸马乳的良好潜力。
[1]叶乐,王越男,刘雨佳,等.蒙古马乳营养成分检测与特征分析[J].中国乳品工业,2022,50(10):23-29.
[2]ZHAO H Z, SONG Q J, GUO H, et al.Characterization of a potential probiotic strain in Koumiss[J].Fermentation,2023,9(2):87.
[3]王小标,武运,王璐,等.中心组合设计优化合生元酸马乳中乳酸菌的生长[J].食品工业科技,2016,37(6):216-220.
[4]倪慧娟.新疆地区和青海地区传统发酵乳制品中酵母菌的生物多样性[D].呼和浩特:内蒙古农业大学,2009.
[5]XUE W K,YUAN X X,JI Z J,et al.Nutritional ingredients and prevention of chronic diseases by fermented koumiss: a comprehensive review[J].Front Nutr,2023,10:1270920.
[6]WURIHAN, BAO L S, HASIGAOWA, et al.Bacterial community succession and metabolite changes during the fermentation of koumiss,a traditional Mongolian fermented beverage[J].Int Dairy J,2019,98:1-8.
[7]刘敏敏,贺银凤.酸马奶中具有潜在共生性乳酸菌和酵母菌的筛选[J].食品科学,2011,32(11):255-259.
[8]HOU Q C,LI C K,LIU Y H,et al.Koumiss consumption modulates gut microbiota,increases plasma high density cholesterol,decreases immunoglobulin G and albumin[J].J Funct Foods,2019,52:469-478.
[9]蔡扩军,妥彦峰,徐敏,等.新疆传统发酵乳制品调研及其发酵微生物种质资源分析[J].中国乳品工业,2024,52(2):12-19.
[10]朱建军,王康,刘彦敏,等.酸马奶的微生物学及生产工艺研究现状[J].食品科技,2022,47(1):13-19.
[11]王琪,蔡建,高秀,等.黄泡野生酵母菌的筛选鉴定及其发酵性能研究[J].中国酿造,2024,43(6):182-188.
[12]蔡扩军,妥彦峰,徐敏,等.新疆传统发酵乳制品调研及其发酵微生物种质资源分析[J].中国乳品工业,2024,52(2):12-19.
[13]焦媛媛,杜丽平,孙文,等.优良梨汁发酵乳酸菌的筛选与发酵性能分析[J].食品科学,2019,40(2):141-145.
[14]马文瑞,孙志伟,石俊,等.非酿酒酵母Nakazawaea ishiwadae GDMCC 60786产乙酸乙酯的诱变菌株筛选及其安全性评价[J].食品科学,2023,44(10):165-172.
[15]胜利.酸马奶发酵剂菌株的筛选及其发酵工艺优化[D].呼和浩特:内蒙古农业大学,2022.
[16]蒋羽柔,蔡建,高秀,等.云南杨梅发酵液中酵母菌筛选及耐受性研究[J].中国酿造,2024,43(3):145-150.
[17]徐晓丹,潘宇,柯尊丽,等.高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制[J].食品科学,2017,38(12):63-68.
[18]OLIVEIRA R D,LOPES A C A,PEREIRA R A,et al.Selection of potentially probiotic Kluyveromyces lactis for the fermentation of cheese whey-based beverage[J].Ann Microbiol,2019,69(11):1361-1372.
[19]廖一漠,敖晓琳,康海燕,等.传统发酵食品中乳酸菌与酵母菌互作机制研究进展[J].食品与发酵工业,2023,49(3):340-346.
[20]潘庆珉,杨洁,岳海涛,等.阿勒泰地区酸驼乳中酵母菌的分离鉴定及耐受性分析[J].中国乳品工业,2023,51(6):27-31,39.
[21]张雨薇.牦牛酸肉发酵剂的开发及其对牦牛酸肉的品质影响[D].雅安:四川农业大学,2023.
[22]任飞鸿,赵婷婷,黄小丹.益生菌的抗生素耐药性特征研究进展[J].实用预防医学,2024,31(7):887-892.
[23]刘木兰,唐白露,旷琦颖,等.五株有机高分子化合物降解菌的生物安全性分析[J].中国酿造,2023,42(2):132-137.
[24]BADALI H,WIEDERHOLD N P.Antifungal resistance testing and implications for management[J].Curr Fungal Infect R,2019,13:274-283.
[25]周浩,栾林众,刘继超,等.乳品中耐药微生物污染及blaTEM基因溯源[J].中国食品学报,2021,21(10):255-261.
[26]张萌萌,赵雪妮,双全,等.马奶营养品质及功能特性的发酵动态分析[J].食品与发酵工业,2022,48(7):103-109.