甜樱桃(Prunus avium L.)属于蔷薇科李属乔木,其具有丰富的膳食纤维、多酚、类胡萝卜素和维生素C,具有促进减肥、抗癌、抗炎、降低心血管疾病和调节肠道消化等功能[1-2]。据统计,2023年我国甜樱桃总产量约160万t,但甜樱桃不容易存放,常温下存放时间不超过5 d[3-4]。因此,部分樱桃被加工成樱桃罐头[5]、樱桃汁[6]、樱桃果酱[7]、樱桃果冻[8]、樱桃果脯[9]、樱桃酒[10]等产品。因樱桃果酒富含营养成分,可以调节机体免疫[11]、促进血液循环和机体代谢、改善心脑血管功能[12-13],越来越受年轻消费者喜爱。果酒是以新鲜水果为主要原料,经全部或部分酒精发酵而成的低度发酵酒[14]。目前,关于樱桃果酒的研究报道主要集中于加工工艺优化[15]、香气组分分析[16]等方面。
发酵动力学模型通常是用于预测酵母发酵、产物生成和底物消耗的相互作用和变化规律[17-18]。发酵动力学的研究用于预测酵母发酵性能的动力学行为,Logistic模型、SGompertz模型等是广义的线性回归分析模型,主要用于数据分析、经济预测等,适合的发酵模型可能有助于了解发酵过程以及合理控制发酵过程[19]。张琪等[20]用Logistic模型进行拟合能较好反映黑加仑果酒发酵过程中各项指标的变化。靳梦楚等[21]应用经典模型对红心火龙果果酒的酒精度、酵母菌数目及残糖量进行拟合,结果表明,Logistic和Dose Resp模型能够较好地描述发酵过程。目前,关于樱桃果酒的发酵动力学、发酵过程中抗氧化物质含量及抗氧化能力变化的研究较少。
本研究采用Logistic模型、DoseResp模型、SGompertz模型及Boltzmann模型对酵母菌数变化、乙醇生成及总糖消耗进行非线性拟合,建立发酵动力学模型,对樱桃果酒发酵过程中总酚和总黄酮含量进行测定,并通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基(·OH)清除能力分析其抗氧化能力,并对樱桃果酒中活性成分与抗氧化能力进行相关性分析,以期为樱桃果酒的发酵生产关键控制点提供相应的理论基础,带动樱桃果酒工业化生产具有重要意义。
1 材料与方法
1.1 材料与试剂
拉宾斯甜樱桃(Prunus avium L.):市售;果酒酵母L.A.L13:法国LAMOTHE-ABIET公司;果胶酶(酶活4万U/g):山东隆科特酶制剂有限公司;亚硝酸钠、蒽酮、硝酸铝、碳酸钠、FeSO4、水杨酸、氢氧化钠、无水乙醇(均为分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
SpectraMax iD3型酶标仪:美谷分子仪器有限公司;HH-6数显恒温水浴锅:金坛市鸿科仪器厂;Agilent 7890A气相色谱仪(附氢火焰离子化检测器(flame ionization detector,FID)):美国Agilent公司;血球板计数器(25×16):无锡德凡仪器有限公司;PS-50CL恒温恒湿培养箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 樱桃果酒酿造工艺流程及操作要点
新鲜樱桃→挑选→除梗去核→打浆→酶解→调整成分→接种、发酵→樱桃果酒成品
操作要点:选择成熟度良好、颜色深的新鲜甜樱桃,去除樱桃的果梗和果核,除梗去核后用打浆机破打浆,加入0.02 g/L果胶酶于45 ℃酶解2 h,加入白砂糖调整糖度至170 g/L,搅拌均匀,加入0.2 g/L果酒酵母于20 ℃条件下恒温发酵,当总糖含量在3 d内不发生变化,则到达发酵终点。樱桃果酒发酵过程中每隔1 d取样一次直至发酵结束,樱桃果酒所取得试样使用4层纱布进行过滤,将滤液在4 ℃条件下离心(4 000 r/min、10 min),取上清液即为樱桃果酒成品。
1.3.2 分析检测
酵母菌数量:采用血球计数板测定;酒精度:采用GB 5009.225—2023《酒和食用酒精中乙醇浓度的测定》[22]中气相色谱法测定;总糖含量:采用蒽酮-硫酸法测定[23]。
1.3.3 活性成分的测定
总酚含量的测定采用张翼钊等[24]的方法,取1 mL樱桃果酒到容量瓶中,再分别加入1 mL的福林酚、1 mL质量分数为10%的碳酸钠溶液,以蒸馏水定容至10 mL并于75 ℃的水浴锅内保温10 min。以没食子酸质量浓度(x)为横坐标,以波长765 nm处的吸光度值为纵坐标(y),绘制没食子酸标准曲线[24],获得标准曲线回归方程为y=7.256 7x+0.012 5,相关系数R2=0.998 5。
黄酮含量的测定采用常虹等[25]的方法,取1 mL样品液,加入0.5%亚硝酸钠溶液0.75 mL,静置6 min后加入0.75 mL 1%硝酸铝溶液,静置6 min,加入0.4%NaOH溶液10 mL,加70%体积分数乙醇溶液定容至25 mL,振荡混匀,静置3 min。以芦丁质量浓度(x)为横坐标,以波长510 nm处的吸光度值[26](y)为纵坐标,绘制芦丁标准曲线,获得芦丁标准曲线回归方程为y=10.317x+0.004 7,相关系数R2=0.994 3。
1.3.4 抗氧化活性的测定
DPPH自由基清除能力的测定:参考FENTIE E G等[27]的方法进行修改。在比色管中加入2 mL果酒和DPPH乙醇溶液(0.2 mmol/L)混合均匀,避光静置一段时间后,于波长517nm处测定样品管的吸光度值。DPPH自由基清除率计算公式如下:
式中:A空为DPPH醇溶液与无水乙醇的吸光度值;A样为上述溶液的吸光度值;A对为样品液本身的吸光度值[27]。
羟自由基清除能力的测定:参考程宏桢等[28]方法进行修改。在比色管中加入樱桃果酒、FeSO4溶液(6 mmol/L)、H2O2溶液(6 mmol/L)、水杨酸溶液(6 mmol/L)各1 mL后混匀,避光静置一段时间后测定其在波长510 nm处的吸光度值。·OH清除率计算公式如下:
式中:A空为无样品液的吸光度值;A样为上述溶液的吸光度值;A对为无水杨酸溶液的吸光度值[28]。
1.3.5 数据处理及统计分析
应用Origin 2022软件和SPSS 26.0软件进行绘图、非线性拟合以及发酵过程中抗氧化活性物质与抗氧化能力的相关性分析。比较不同模型中相关系数R2后选取拟合度较好地模型建立发酵动力学模型并对其变化情况进行描述分析。
2 结果与分析
2.1 樱桃果酒发酵过程中总糖含量、酒精度及酵母菌数的变化
樱桃果酒发酵过程中总糖、酒精度、酵母菌数量变化见图1。由图1可知,在酵母菌生长过程中,发酵时间为0~3 d时,酵母菌生长繁殖进入延滞期。在延滞期,酵母细胞需要适应环境,生长速度较慢。由于樱桃果汁中的大量营养物质被利用,发酵时间为4~8 d时,酵母菌生长繁殖进入对数期。发酵时间为9~11 d时,酵母菌数量增加减缓,是由于总糖大量消耗以及酒精的快速积累,此时酵母菌生长进入到稳定期。当发酵时间>11 d,酵母菌数量开始减少,酵母菌对糖类的消耗变少、酒精的产生减少,酵母菌生长开始进入凋亡阶段。
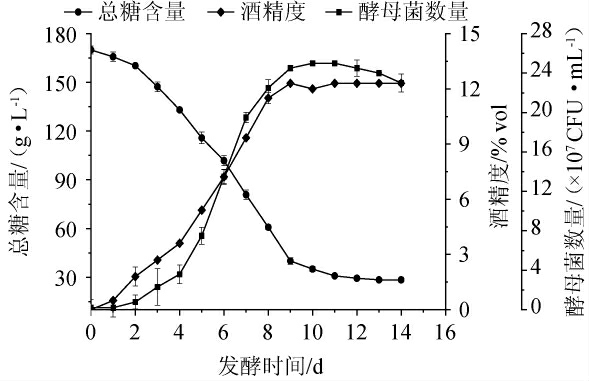
图1 樱桃果酒发酵过程中总糖含量、酒精度、酵母菌数量的变化
Fig.1 Changes of total sugar contents, alcohol content and yeast number during cherry fruit wine fermentation process
酒精度的变化趋势与酵母菌生长趋势一致。酵母菌生长处于延滞期时,酒精度增加缓慢,酵母菌处于对数生长期时,酒精度快速积累,当酵母菌生长进入稳定期时,酒精度逐渐趋于平稳,当发酵结束时,酒精度为12.3%vol。本研究结果与仙人掌果酒变化规律[29]一致。
发酵时间为0~9 d时,总糖含量逐渐降低,是由于酵母菌数量增长会消耗还原糖;当发酵时间>9 d,总糖含量变化趋于稳定,其原因可能是,乙醇对酵母菌的生长繁殖起抑制作用。
2.2 建立樱桃果酒发酵动力学模型
2.2.1 酵母菌生长动力学模型
由图1可知,酵母菌的生长繁殖在发酵后期(>11 d)进入凋亡阶段,因此对生长延滞期到稳定期(0~11 d)酵母菌生长变化规律进行拟合,3种模型下酵母菌生长拟合方程及其相关系数见表1。由表1可知,相较于其他两种模型(R2>0.98),Boltzmann模型对酵母菌生长繁殖拟合度最好,其相关系数R2为0.996 2。因此,酵母菌生长变化可选Boltzman模型进行拟合,在该模型下酵母菌生长拟合曲线见图2。由图2可知,酵母菌生长繁殖在发酵过程中符合“S”型曲线生长趋势,酵母菌数量在稳定期结束(11 d)时达到最高值,为2.5×108 CFU/mL。
表1 酵母菌生长拟合方程及其相关系数
Table 1 Yeast growth fitting equation and its correlation coefficient

模型 拟合方程 相关系数R2 Boltzmann y=24.483 42- 23.933 15 1+e x-5.804 35 0.909 69 0.996 2 Logistic y=24.483 42- 23.933 15 1+ x 5.798 55( )6.72845 0.993 2 SGompertz y=24.813 56×e-e[-0.72445(x-5.14028)]0.989 3
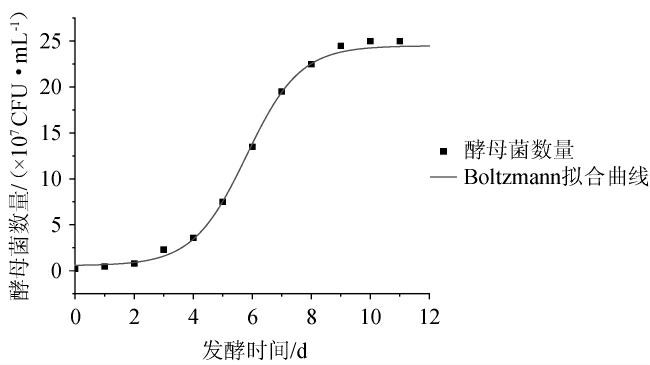
图2 酵母菌生长拟合方程及其相关系数
Table 2 Yeast growth fitting equation and its correlation coefficient
2.2.2 乙醇生成动力学模型
乙醇生成拟合方程及其相关系数见表2。由表2可知,拟合后Boltzman模型、Logistic模型及SGompertz模型的相关系数R2分别0.991 9、0.983 3、0.983 4。其中,Boltzmann模型的相关系数R2较高,因此,选用Boltzmann模型来拟合乙醇生成曲线,这与熊亚等[30-31]在嘉宝果果醋和果酒产物生成拟合模型一致。Boltzmann模型下乙醇生成拟合曲线见图3。
表2 乙醇生成拟合方程及其相关系数
Table 2 Fitting equation of alcohol generation and its correlation coefficient

模型 拟合方程 相关系数R2 Boltzmann y=12.572 44- 12.40 1+e x-5.366 22 1.440 81 0.991 9 Logistic y=13.041 12- 12.182 93 1+ x 5.540 18( )3.91214 0.983 3 SGompertz y=13.058 71×e-e[-0.41607(x-4.989)]0.983 4
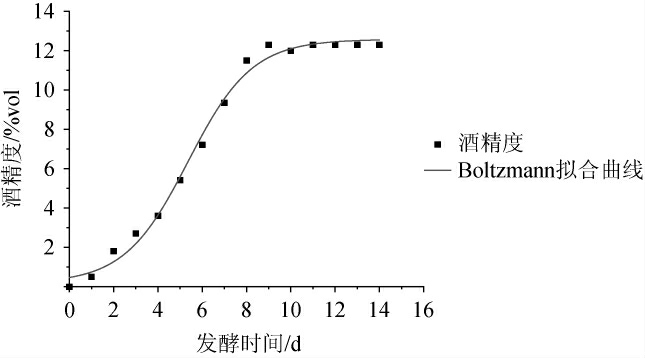
图3 Boltzmann模型下酵母菌生长拟合曲线
Fig.3 Fitting curve of yeast growth under Boltzmann model
由图3可知,发酵时间为0~9 d时,乙醇生成速率加快;当发酵时间>9 d,乙醇含量变化趋于稳定,其原因可能是酵母菌生长进入稳定期;发酵时间为9 d时,酒精度达到最高值,为12.3%vol。
2.2.3 总糖消耗动力学模型
总糖消耗拟合方程及其相关系数见表3。由表3可知,Logistic模型、DoseResp模型、Boltzman模型相关系数R2分别为0.991 6、0.996 5、0.996 5。其中,Boltzman和DoseResp模型的相关系数R2均高于Logistic模型。总糖消耗实际值与预估值在Boltzmann和DoseResp模型下无显著差异(P=0.067>0.05),均能较好地描述发酵过程中总糖的变化。总糖消耗拟合曲线见图4。
表3 总糖消耗拟合方程及其相关系数
Table 3 Fitting equation of total sugar consumption and its correlation coefficient

模型 拟合方程 相关系数R2 Boltzmann y=23.974 19- 149.880 33 1+e x+5.925 15 1.772 94(152.911 98)0.996 5 Logistic y=12.271 85-1+ x 6.294 11( )3.2471 0.991 6 DoseResp y=23.974 19+ 149.880 33 1+10-0.24496×(5.92515-x)0.996 5
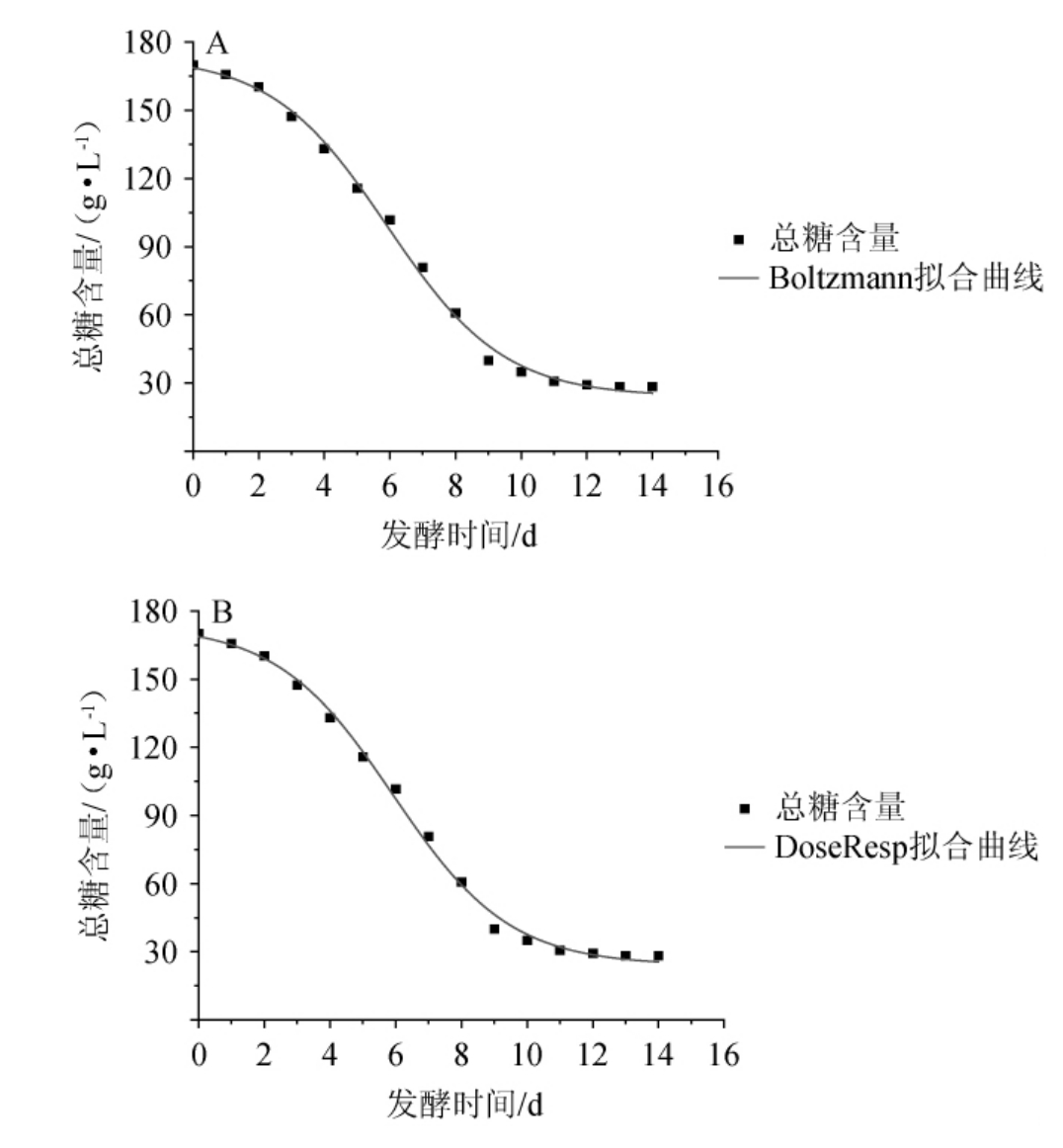
图4 Boltzmann模型(A)及DoseResp模型(B)下总糖消耗拟合曲线
Fig.4 Fitting curves of total sugar consumption under Boltzmann model (A) and DoseResp model (B)
由图4可知,在酵母菌生长凋亡阶段前(0~9 d),总糖逐渐被消耗;发酵时间>9 d,总糖消耗趋于平缓,表明樱桃果酒发酵即将结束;发酵时间为14 d时,总糖含量最低,为28.3 g/L。本研究结果与郝丽粉等[32]结果一致。
2.3 樱桃果酒发酵过程中抗氧化物质与抗氧化能力的变化
2.3.1 樱桃果酒在发酵过程中总酚、总黄酮含量的测定
总酚和黄酮是樱桃果酒中的主要酚类物质,具有抗氧化活性[33]。发酵过程中樱桃果酒酚类物质的变化见图5。在发酵过程中樱桃果酒总酚含量及总黄酮含量的变化均呈先上升后下降的趋势。由图5A可知,发酵前樱桃果酒的总酚质量浓度为2.16 mg/mL,当发酵时间为0~4 d时,总酚含量缓慢增加;当发酵时间为5~7 d,快速增加;当发酵时间为7 d,达最高值4.08 mg/mL;当发酵时间>7 d,总酚含量缓慢降并趋于稳定,发酵结束时,总酚含量为3.75mg/mL。由图5B可知,发酵前樱桃果酒的总黄酮质量浓度为0.228 mg/mL,当发酵时间为0~4 d时,总黄酮含量缓慢增加;当发酵时间为5~7d,总黄酮含量快速增加;当发酵时间为7 d,总黄酮含量达最高值,为0.42 mg/mL;当发酵时间>7 d,总黄酮含量逐渐下降并趋于稳定,发酵结束时总黄酮含量为0.27 mg/mL。
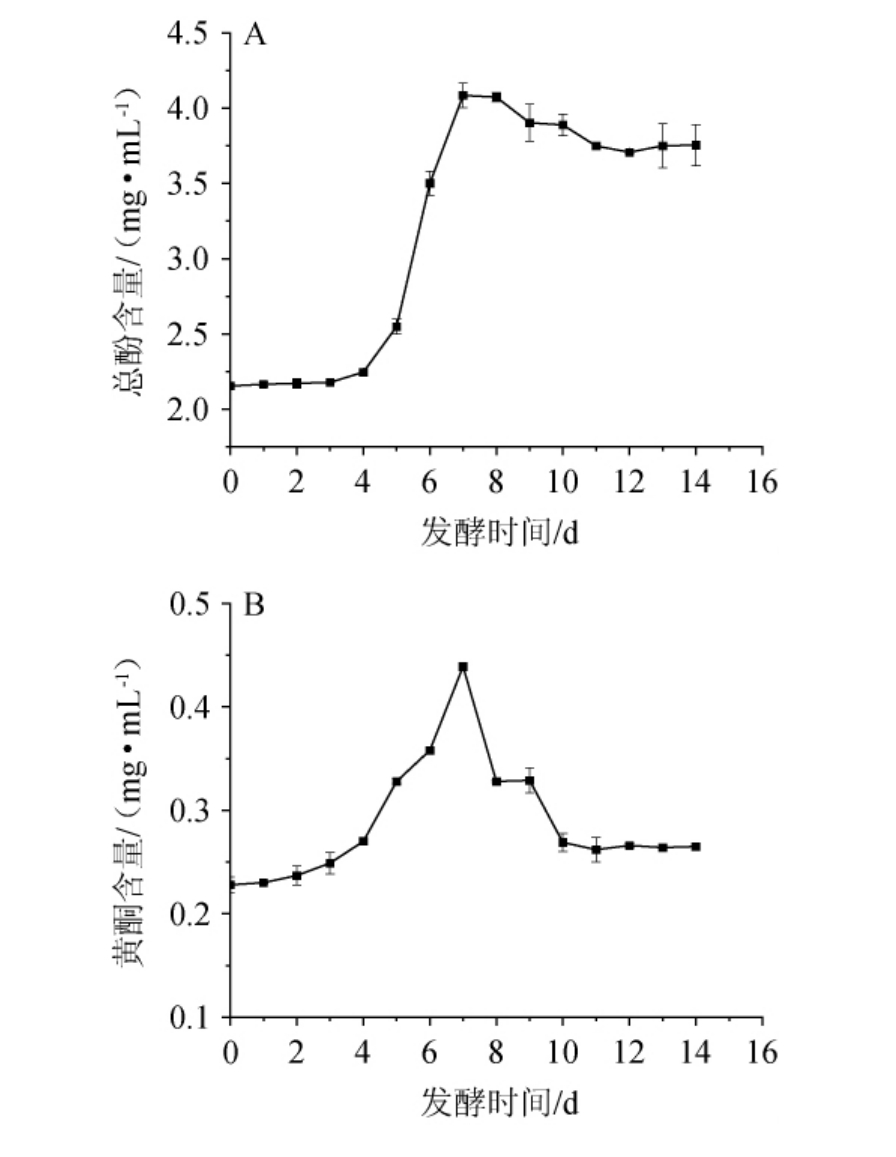
图5 樱桃果酒发酵过程中总酚(A)和总黄酮(B)含量的变化
Fig.5 Changes of total phenols (A) and total flavonoids (B) contents in cherry fruit wine during fermentation process
2.3.2 樱桃果酒在发酵过程中抗氧化能力的测定
樱桃果酒发酵过程中DPPH自由基清除率和·OH清除率的变化见图6。由图6可知,樱桃果酒在发酵过程中DPPH自由基清除率和·OH清除率变化规律一致,均为先上升后下降再趋于平稳的趋势。当发酵时间为0~4 d时,DPPH自由基清除率和·OH清除率缓慢上升;当发酵时间为4~7 d,两者快速增加;当发酵时间为7 d达到最高值,分别为80.87%、79.24%,其原因可能是,发酵过程中黄酮等酚类物质降解造成了抗氧化成分的减少[27];当发酵时间为7~10 d,DPPH自由基清除率和·OH自由基清除率均呈下降趋势;发酵时间>10 d,DPPH清除率和·OH清除率均趋于稳定。
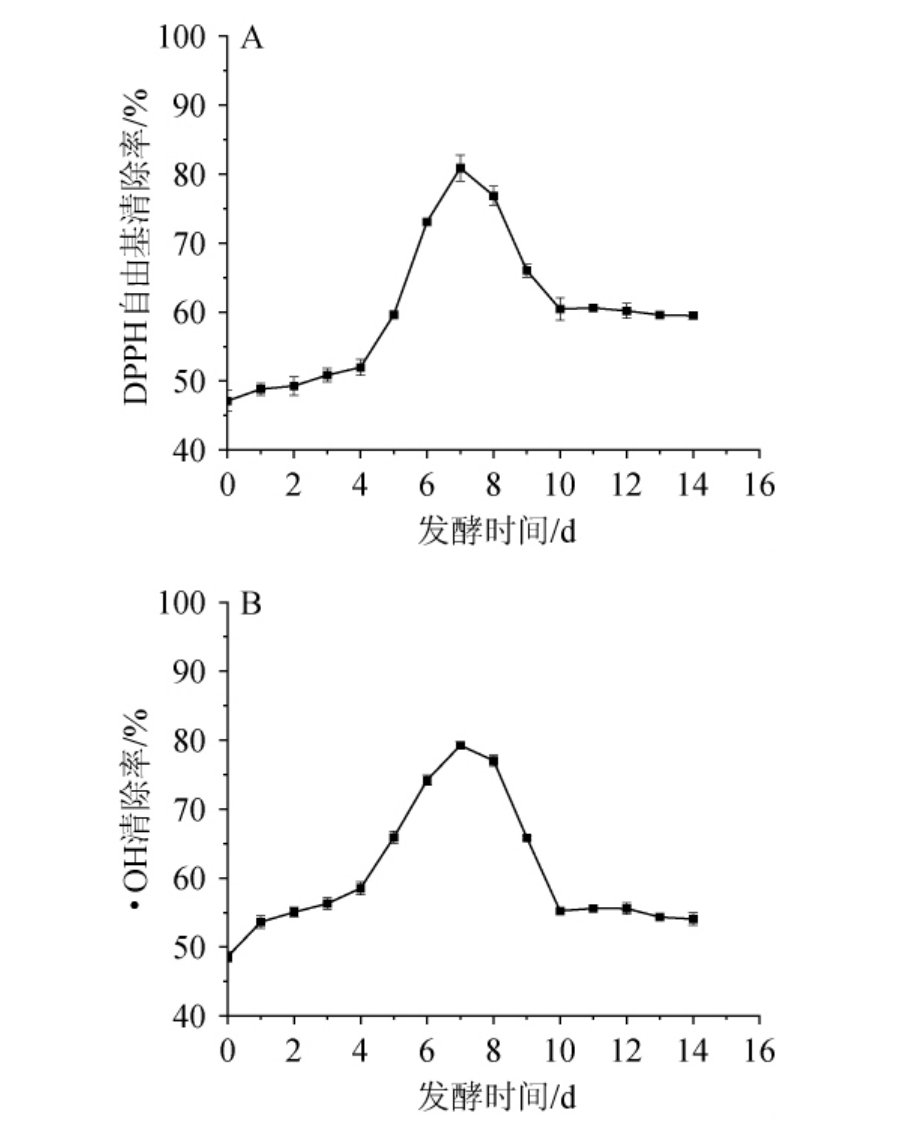
图6 樱桃果酒发酵过程中DPPH自由基清除率(A)和·OH清除率(B)的变化
Fig.6 Changes of DPPH radicals scavenging rates (A) and·OH radicals scavenging rates (B) in cherry fruit wine during fermentation process
2.3.3 活性物质与抗氧化活性的相关性分析
酚类物质和抗氧化能力之间存在直接相关性[34]。樱桃果酒中活性物质与抗氧化活性的相关性分析见表5。由表5可知,在发酵过程中DPPH自由基清除率与总酚、总黄酮呈极显著相关(P<0.01)(相关系数R2为0.805 5、0.885 1)。·OH清除率与总黄酮(R2=0.945 7)呈极显著相关(P<0.01),而·OH清除率与总酚相关性不显著(P>0.05)。
表5 樱桃果酒中活性物质与抗氧化活性的相关性分析
Table 5 Correlation analysis of active substances and antioxidant activities in cherry fruit wine
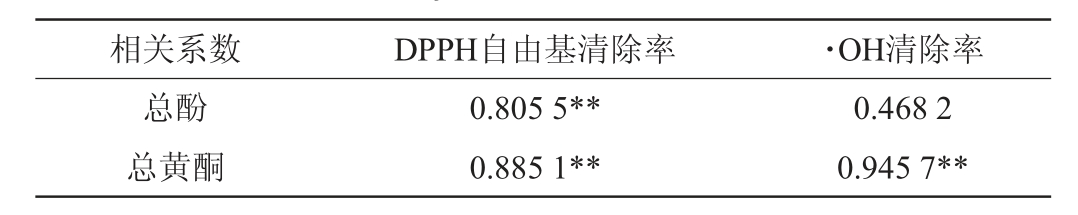
注:“**”表示相关性极显著(P<0.01)。
相关系数 DPPH自由基清除率 ·OH清除率总酚总黄酮0.805 5**0.885 1**0.468 2 0.945 7**
3 结论
应用Logistic模型、DoseResp模型、SGompertz模型及Boltzmann模型对樱桃果酒发酵过程中总糖消耗、酒精生成和酵母菌数量进行非线性拟合,拟合相关系数R2均>0.99,表明所选拟合模型能较好地模拟发酵过程及描述其发酵动力学特征。樱桃果酒发酵工程中,总酚、总黄酮含量及1,1-二苯基-2-三硝基苯肼(DPPH)自由基和羟自由基清除率均呈先升高再下降后趋于稳定的的趋势。发酵过程中DPPH自由基清除率与总酚、总黄酮呈极显著相关(P<0.01),·OH清除率与总黄酮呈极显著相关(P<0.01)。本研究对樱桃果酒发酵动力学及抗氧化能力进行分析,为樱桃果酒的工业化生产提供一定的基础。
[1]KELLEY D S,ADKINS Y,LAUGERO K D.A review of the health benefits of cherries[J].Nutrients,2018,10(3):368.
[2]AFONSO S, OLIVEIRA I V, MEYER A S, et al.Phenolic profile and bioactive potential of stems and seed kernels of sweet cherry fruit[J].Antioxidants,2020,9(12):1295.
[3]黄青山,刘冰雁.樱桃贮藏保鲜技术研究进展[J].安徽农学通报,2022,28(10):55-59,71.
[4]兰鑫哲,姜爱丽,胡文忠.甜樱桃采后生理及贮藏保鲜技术进展[J].食品工业科技,2011,32(11):535-538.
[5]赵珺泽,仪淑敏,隋韶奕.樱桃罐头脱色问题与加工工艺优化研究[J].中国食品工业,2023(2):90-92,89.
[6]ÖZEN M,ÖZDEMIR N,FILIZ B E,et al.Sour cherry(Prunus cerasus L.)vinegars produced from fresh fruit or juice concentrate: Bioactive compounds, volatile aroma compounds and antioxidant capacities[J].Food Chem,2020,309:125664.
[7]NOURMOHAMMADI A,AHMADI E,HESHMATI A.Optimization of physicochemical, textural, and rheological properties of sour cherry jam containing stevioside by using response surface methodology[J].Food Sci Nutr,2021,9(5):2483-2496.
[8]何子杨.樱桃酒渣果胶的提取、理化性质及制备果冻的研究[D].泰安:山东农业大学,2021.
[9]杨硕,张双灵,姜文利,等.低糖大樱桃裂果果脯的加工工艺及品质评价[J].现代食品科技,2021,37(1):192-198,267.
[10]CHOCKCHAISAWASDEE S,GOLDING J B,VUONG Q V,et al.Sweet cherry:Composition,postharvest preservation,processing and trends for its future use[J].Trends Food Sci Tech,2016,55:72-83.
[11]李曼祎.枸杞果酒的研制[D].无锡:江南大学,2021.
[12]成冬冬,迟玉洁,甄晨瑞,等.山楂酒的研究现状及前景分析[J].食品科技,2021,46(10):59-63.
[13]HASEEB S,ALEXANDER B,BARANCHUK A.Wine and cardiovascular health: a comprehensive review[J].Circulation, 2017, 136(15):1434-1448.
[14]张雪儿,杨建,刘振宇,等.不同原料及预处理方法对复合甘蔗果酒品质的影响[J].中国酿造,2024,43(3):163-169.
[15]张文英,张俊.姜汁毛樱桃果酒的工艺研究[J].饮料工业,2020,23(5):17-21.
[16]XIAO Q,ZHOU X,XIAO Z B,et al.Characterization of the differences in the aroma of cherry wines from different price segments using gas chromatography-mass spectrometry, odor activity values, sensory analysis,and aroma reconstitution[J].Food Sci Biotechnol,2017,26:331-338.
[17]CHANPRASARTSUK O,PRAKITCHAIWATTANA C.Growth kinetics and fermentation properties of autochthonous yeasts in pineapple juice fermentation for starter culture development[J].Int J Food Microbiol,2022,371:109636.
[18]李桂峰,燕妮,原潞,等.青枣果酒发酵动力学模型[J].食品工业,2021,42(5):88-91.
[19]SHADBAHR J, KHAN F, ZHANG Y.Kinetic modeling and dynamic analysis of simultaneous saccharification and fermentation of cellulose to bioethanol[J].Energ Conwers Manage,2017,141(6):236-243.
[20]张琪,朱立斌,朱丹,等.黑加仑果酒发酵动力学研究[J].中国酿造,2020,39(2):125-128.
[21]靳梦楚,李雪,张宇翔,等.红心火龙果果酒发酵动力学研究[J].食品科技,2017,42(6):106-110.
[22]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[23]杨勤,谷文超,周浓,等.苯酚-硫酸法与蒽酮-硫酸法测定地参多糖的比较研究[J].食品科技,2020,45(1):343-350.
[24]张翼钊,王宝刚,李文生,等.温度波动对贮藏猕猴桃品质劣变的影响[J].食品研究与开发,2023,44(19):43-48,103.
[25]常虹,王爽,周家华,等.体外模拟消化对鲜切苹果皮渣黄酮类物质及其还原力的影响[J].食品工业科技,2022,43(20):39-44.
[26]巴俊文.红树莓-蓝莓复合果酒工艺研究及其香气成分分析[D].锦州:渤海大学,2019.
[27]FENTIE E G,JEONG M,EMIRE S A,et al.Fermentation dynamics of spontaneously fermented Ethiopian honey wine,Tej[J].LWT-Food Sci Technol,2022,155:112927.
[28]程宏桢,蔡志鹏,王静,等.百香果全果酒发酵工艺优化及体外抗氧化性比较分析[J].中国酿造,2020,39(4):91-97.
[29]李雪,白新鹏,曹君,等.仙人掌果酒发酵动力学及其抗氧化性[J].食品科学,2017,38(4):87-92.
[30]熊亚,李敏杰.嘉宝果果醋发酵动力学模型建立[J].中国调味品,2023,48(2):92-96.
[31]李敏杰,熊亚.嘉宝果果酒发酵动力学模型的建立[J].食品科技,2022,47(9):83-87.
[32]郝丽粉,叶晓芳,张静进,等.百香果酒发酵动力学及抗氧化活性研究[J].中国酿造,2023,42(12):219-225.
[33]YILMAZ Y, TOLEDO R T.Health aspects of functional grape seed constituents[J].Trends Food Sci Tech,2004,15(9):422-433.
[34]WAN F C, FENG C F, LUO K Y, et al.Effect of steam explosion on phenolics and antioxidant activity in plants: A review[J].Trends Food Sci Tech,2022,124:13-24.