桃红葡萄酒,也称为玫瑰葡萄酒或混合葡萄酒,通过将葡萄汁与葡萄皮浸泡一段时间来制作,以获得浅粉红至深粉红的颜色。这种方法使得桃红葡萄酒在口感和风味上融合了白葡萄酒和红葡萄酒的特点[1],深受年轻人的喜爱。葡萄酒香气成分分析有利于指导桃红葡萄酒的生产过程,提高其品质[2]。糖苷结合态香气物质和半胱氨酸结合态香气物质是目前研究较多的结合态香气物质,且糖苷结合态香气物质在葡萄与葡萄酒中储量丰富[3]。其中,C13-降异戊二烯及其衍生物具有很低的气味阈值,是赤霞珠等非芳香型葡萄中的主要香气物质[4],对桃红葡萄酒的香气具有重要的影响。如β-紫罗兰酮具有紫罗兰香气、β-大马士酮具有玫瑰和热带水果和煮苹果的香气[5]。这些化合物提升了葡萄酒香气的多样性和复杂性。
这些糖苷类香气的产生依赖发酵过程中的β-葡萄糖苷酶等胞外酶,而从葡萄中提取的β-葡萄糖苷酶受酒精抑制[6],酿酒酵母产生的β-葡萄糖苷酶活性在发酵环境中无法有效地催化水解反应[7]。假丝酵母属(Candida)、毕赤酵母属(Pichia)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)等非酿酒酵母的分泌的β-葡萄糖苷酶可增加糖苷结合态萜烯类香气物质的释放[8],且在酿酒条件下的环境适应性更高[9-10]。但非酿酒酵母往往无法单独完成发酵,需要和酿酒酵母共同作用,常见且有效的方式是次序接种这种方法可以优化发酵过程,改善产品的风味和质量[11]。接种了非酿酒酵母后次序接种酿酒酵母可以更好地释放糖苷结合香气物质,增加香气复杂性和萜烯类物质的含量[12-13]。国内的酿酒师过度依赖商业酿酒酵母的使用,不同产区葡萄酒风格单一,存在同质化问题[14]。
课题组先前的研究已经证实两株非酿酒酵母有高产葡萄糖苷酶的特性和良好的乙醇耐受性[15]。本研究选用光滑假丝酵母(Candida glabrata)D18和葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)H30两株高产β-葡萄糖苷酶菌株分别与商业酿酒酵母(NDA21)次序接种发酵,酿造赤霞珠桃红葡萄酒,并对发酵过程中糖、有机酸、甘油含量及乙醇体积分数的动态变化进行分析,采用顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)对葡萄酒的挥发性风味成分进行分析,并对结果进行主成分分析(principal component analysis,PCA)。旨在为提高桃红葡萄酒的品质提供技术支持,探究菌株高产β-葡萄糖苷酶特性对葡萄酒香气特征和整体特性的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
葡萄汁:2019年怀来产区赤霞珠;光滑假丝酵母(Can dida glabrata)D18、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)H30:由北京市葡萄科学与酿酒技术重点实验室筛选;商业酿酒酵母NDA21:法国Fermentis公司。
1.1.2 试剂
柠檬酸、乳酸、酒石酸、乙酸、苹果酸、果糖标准品(纯度≥98%):上海西格玛奥德里奇贸易有限公司;3-辛醇(纯度≥98%):上海阿拉丁生化科技股份有限公司;无水乙醇、甘油(均为分析纯):北京化学工业集团有限公司;蛋白胨、酵母浸粉(均为生化试剂):北京奥博星生物技术有限责任公司;葡萄糖(分析纯):天津市永大化学试剂有限公司。
1.1.3 培养基
WLN培养基:北京奥博星生物技术有限责任公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L。
以上培养基均现用现配,于121 ℃高压灭菌20 min后备用。
葡萄汁培养基:经过0.45 μm的聚醚砜滤膜的葡萄汁。
1.2 仪器与设备
Agilent-7890A气相色谱-5975C质谱联用仪、DB-17ms气相色谱柱(30 m×0.25 mm,0.25 μm):美国Agilent公司;Waters-2695液相色谱仪;Aminex HPX-87H液相色谱柱(300 mm×7.8 mm):美国Bio-Rad公司;Waters-2414示差检测器、Waters-2996二极管阵列检测器、SW-CJ-ID立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;HCY-DA全温振荡培养箱:江苏太仓豪诚实验仪器制造有限公司;HC-2517高速离心机:安徽科大创新股份有限公司中佳分公司。
1.3 方法
1.3.1 桃红葡萄酒加工工艺流程及操作要点

选取新鲜的赤霞珠葡萄,除梗后将葡萄原料带皮进行破碎,同时加入果胶酶(250 mg/L)及二氧化硫(65 mg/L),在4 ℃浸渍24 h,获得酒样的颜色呈粉色,采用手工轻柔压榨取一次汁,含糖量238.7 g/L(以葡萄糖与果糖总和计),将葡萄汁离心(8 000 r/min、10 min),收集上清液,先经0.45 μm的聚醚砜滤膜真空抽滤后,再在超净工作台中使用0.45 μm的聚醚砜滤膜过滤得到无菌的葡萄汁,按2%的接种量接种酿酒酵母NDA21(106 CFU/mL)后置于20 ℃培养箱中静置发酵,当桃红葡萄酒总糖含量<4 g/L时结束发酵,离心(8 000 r/min、10 min)分离上清液后灭菌,即得桃红葡萄酒成品。
1.3.2 接种试验设计
将3株酵母在YPD液体培养基活化(28 ℃、180 r/min条件下培养24 h),然后以10%的接种量接种到葡萄汁培养基预培养(28 ℃、180 r/min条件下培养24 h),菌株浓度为106 CFU/mL。无菌葡萄汁在超净工作台内分装至发酵瓶,装液量为150 mL/250 mL,并设置3个发酵组。发酵组I:光滑假丝酵母与酿酒酵母1∶1次序接种组(组别D18+NDA21)。发酵组II:葡萄汁有孢汉逊酵母与酿酒酵母1∶1次序接种组(组别H30+NDA21)。次序接种组先按1%的接种量接种非酿酒酵母D18和H30,在第4天时,按1%接种量接种菌株NDA21。发酵组III:酿酒酵母NDA21单菌株发酵组(组别NDA21),按2%的接种量接种酿酒酵母NDA21。
1.3.3 桃红葡萄酒理化指标测定
糖度的测定:手持糖度计;葡萄糖、果糖、乙醇、甘油的测定:采用高效液相色谱法,色谱条件[16]:分析柱Aminex HPX-87H(300 mm×7.8 mm),柱温55 ℃;Waters-2414示差检测器,检测器温度40 ℃。进样量10 μL,流动相为0.005 mol/L的硫酸,流速为0.5 mL/min,等度洗脱。以保留时间定性,峰面积定量。
有机酸的测定:采用高效液相色谱法。色谱条件[17]:分析柱Aminex HPX-87H(300 mm×7.8 mm),柱温40 ℃;Waters-2996二极管阵列检测器,检测波长210 nm。进样量10 μL,流动相为0.005 mol/L的硫酸,流速为0.4 mL/min,等度洗脱。以保留时间定性,峰面积定量。
1.3.4 挥发性风味成分分析
参考CHEN D等[18]的顶空固相微萃取(HS-SPME)结合气相色谱质谱联用法(GC-MS)检测葡萄酒样中的挥发性风味成分。
样品的前处理:取5 mL样品过0.45 μm 聚醚砜滤膜,加入100 μL 1 000 mg/L 3-辛醇的甲醇溶液,加入1.2 g氯化钠,涡旋混匀。
HS-SPME:将固相微萃取装置的萃取头在气相色谱的进样口老化,老化温度为250 ℃,老化时间0.5 h。SPME纤维头插入顶空瓶中,在60 ℃、250 r/min振荡10 s、停止10 s的条件下孵育15 min,对样品中的香气进行吸附,吸附时间为30 min。吸附完成后,取出萃取头并迅速插入GC-MS进样口解吸5 min,进行香气物质的分离与测定。
GC条件:J&WDB-17ms色谱柱(30m×0.25mm,0.25μm),进样口温度为250℃;载气为高纯氦气(He),流速为1.0mL/min;采用不分流进样模式;升温程序为初始温度35 ℃保持5 min,以2 ℃/min的速度升至45 ℃,以3 ℃/min 的速度升至180 ℃,最后以10 ℃/min 的速度升至230 ℃,保持5 min。
质谱条件:采用全扫描模式采集信号,电子电离(electronic ionization,EI)源;电子电离能量70 eV;接口温度280 ℃,离子源温度230 ℃,传输线温度280 ℃,四级杆温度150 ℃,扫描质量范围29~500 m/z;倍增器电压(自动调谐+200 V);扫描速度:0.2次/s;无溶剂延迟。
定性分析:将各香气成分的质谱图结果与美国国家标准技术研究所(national institute of standards and technology,NIST)2008和Wiley 275 MS标准谱库对比,采用保留指数进行定性分析;定量分析:采用内标法(3-辛醇)进行半定量分析[19],其计算公式如下:
式中:X为各香气物质的质量浓度,μg/L;f 为内标物的校正因子,f=1;A为酒样中香气物质的峰面积;ρ为3-辛醇的质量浓度,μg/L;A0为3-辛醇的峰面积。
1.3.5 香气活度值计算
香气活度值(odor activity value,OAV)是衡量单个香气化合物对嗅觉感知贡献度的主要方法,由挥发性风味成分质量浓度除以其香气阈值得到,其中OAV>1的挥发性风味成分对酒体香气有直接贡献[20],计算公式如下:
1.3.6 桃红葡萄酒的感官评价
在标准品评室中,由拥有葡萄酒品鉴资格证的7名(3男4女)不同年龄段的品鉴员进行感官评价。采用五点强度法对赤霞珠葡萄酒香气的八个方面(酒精气味、甜味、酸味、花香、水果香、植物类香气、香辛料类香气、不良气味)进行评价。满分为5分,代表香气纯正,优雅、浓郁;0分代表香气不足,有明显缺陷。
1.3.7 数据分析
使用Microsoft Office Excel 2018处理数据,SPSS 19.0软件进行单因素方差分析(One-way ANOVA),Origin 2018、Prism 9绘图。
2 结果与分析
2.1 菌株D18和H30对赤霞珠桃红葡萄酒理化指标的影响
2.1.1 菌株D18和H30对糖、甘油及乙醇的影响
由图1可知,随着发酵时间在0~10 d、0~14 d、0~14 d内的增加,组别NDA21、D18+NDA21、H30+NDA21的糖度、总糖、葡萄糖、果糖含量均快速下降,继续增加发酵时间,其变化趋于平缓。发酵结束,组别NDA21、D18+NDA21与H30+NDA21的总糖含量分别为1.65 g/L、3.97 g/L和3.99 g/L。

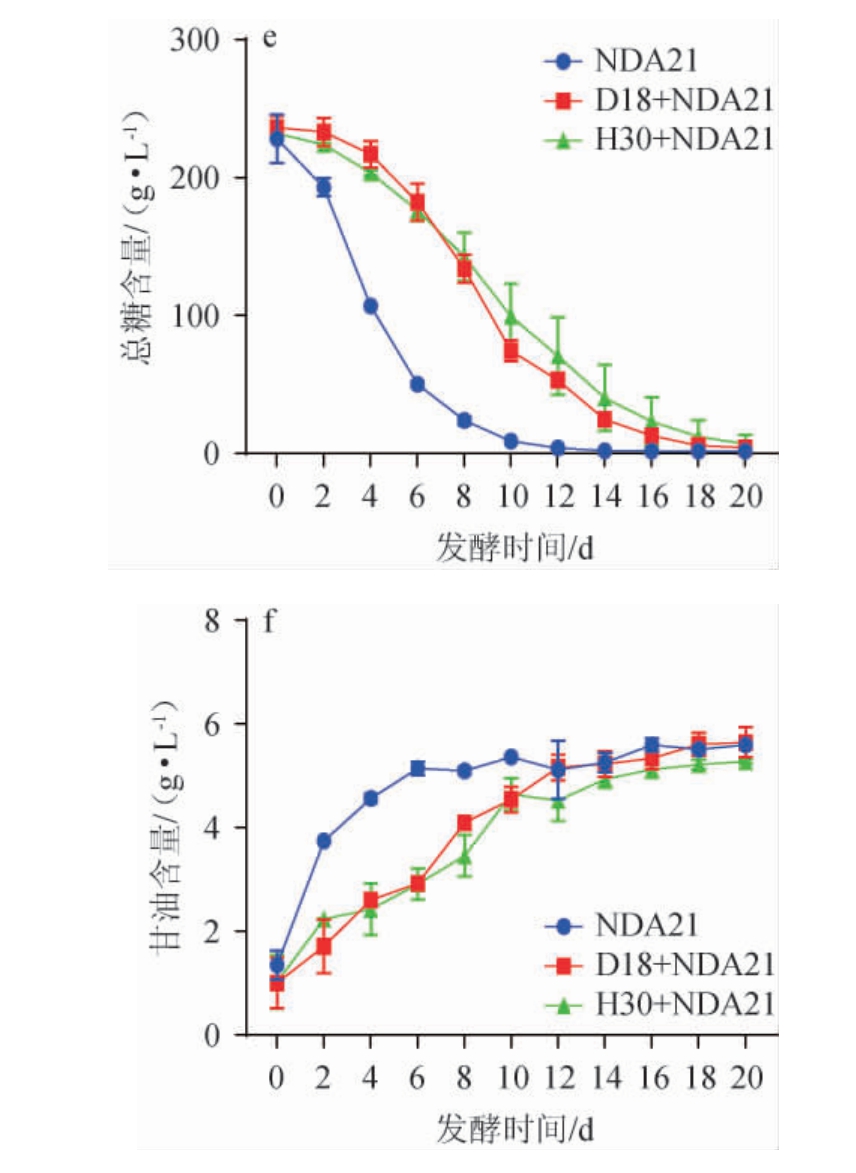
图1 葡萄酒样发酵过程中糖度(a)、乙醇体积分数(b)、葡萄糖(c)、果糖(d)、总糖(e)、甘油(f)含量的变化
Fig.1 Changes of sugar degree (a), ethanol volume fraction (b),contents of glucose (c), fructose (d), total sugar (e) and glycerol (f) during wine fermentation
乙醇和甘油均是酵母无氧呼吸的重要产物,对于葡萄酒的感官品质提升有重要影响。乙醇可以增加葡萄酒苦味和辣味,减少酸味,丰富葡萄酒的酒体[19],甘油能增加葡萄酒的圆润感和甜度,提升葡萄酒的化学稳定性[14]。随着发酵时间在0~10 d、0~18 d、0~18 d范围内的增加,组别NDA21的乙醇体积分数和甘油含量均快速上升,而组别D18+NDA21与H30+NDA21的乙醇和甘油均呈缓慢上升趋势,继续增加发酵时间,变化趋于平稳,发酵结束时,组别NDA21、D18+NDA21与H30+NDA21的乙醇体积分数分别为13.24%、12.67%、12.17%;甘油含量分别为5.59 g/L、5.64g/L、5.27 g/L。
综上,3个发酵组均能有效控制总糖(以葡萄糖计)≤4.0 g/L,均满足国标GB/T 15037—2006《葡萄酒》对干型葡萄酒的规定。其中组别D18+NDA21能产生较低的乙醇和更高的甘油,证明其在桃红葡萄酒发酵中具有一定的潜力。
2.1.2 菌株D18和H30对赤霞珠桃红葡萄酒有机酸含量的影响
有机酸是葡萄酒风味的重要组成部分,酒石酸主要来源于葡萄果实本身,在发酵过程中基本不被酵母或细菌代谢。它可以为葡萄酒提供必要的酸度,从而平衡葡萄酒中的甜味和果味。在5种有机酸中酒石酸含量最高,在菌株NDA21发酵的处理组酒石酸含量最高,为4.69 g/L,组别D18+NDA21、组别H30+NDA21均显著低于组别NDA21,分别为3.41和3.32 g/L。因此,两株非酿酒酵母可降低酒石酸含量。有研究表明,当酒石酸含量为2~4 g/L时,葡萄酒酸度理想,而较高浓度的酒石酸会使葡萄酒的酸度过于尖锐和刺舌,影响整体的感官体验[21]。酒样中柠檬酸、乙酸的范围分别为0.58~0.63 g/L、0.43~0.64 g/L,均满足国标GB/T 15037—2006《葡萄酒》中葡萄酒中柠檬酸≤1.0 g/L,挥发酸(以乙酸计)≤1.2 g/L的要求。发酵后的酒样中苹果酸含量略有降低,为0.38~0.46 g/L。苹果酸经过苹果酸-乳酸发酵后含量逐渐减少,通常由乳酸菌在酒精发酵之后完成[22]。乳酸在葡萄汁和酒样中均未检测出,可能是未进行乳酸菌二次发酵的原因。综上,两株非酿酒酵母与酿酒酵母的次序接种降低酒石酸含量,改良了口感,提高了葡萄酒的品质。不同酵母组合对有机酸影响较小,证明了非酿酒酵母的加入没有影响发酵的稳定性。
表1 葡萄酒样品酒精发酵结束的有机酸含量检测结果
Table 1 Determination results of organic acid content at the end of alcohol fermentation in rose wine samples
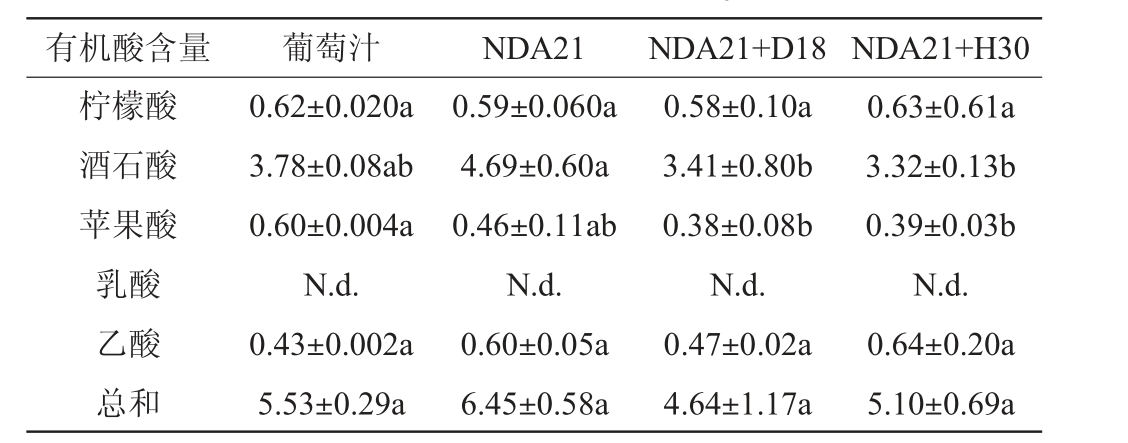
注:同一行不同字母表示所测得的数据之间差异显著(P<0.05)。“N.d.”表示未检出。下同。
有机酸含量 葡萄汁 NDA21 NDA21+D18 NDA21+H30柠檬酸酒石酸苹果酸乳酸乙酸总和0.62±0.020a 3.78±0.08ab 0.60±0.004a N.d.0.43±0.002a 5.53±0.29a 0.59±0.060a 4.69±0.60a 0.46±0.11ab N.d.0.60±0.05a 6.45±0.58a 0.58±0.10a 3.41±0.80b 0.38±0.08b N.d.0.47±0.02a 4.64±1.17a 0.63±0.61a 3.32±0.13b 0.39±0.03b N.d.0.64±0.20a 5.10±0.69a
2.2 葡萄酒挥发性风味成分分析
采用顶空固相微萃取(HS-SPME)结合气相色谱-质谱联用(GC-MS)对葡萄汁和葡萄酒的挥发性风味成分进行分析,结果见表2。葡萄酒样共检测出52种挥发性风味成分。其中,组别NDA21、D18+DNA21和H30+NDA21分别检测出挥发性风味物质38种、41种、40种。酯类物质29种、31种、30种,醇类物质3种、3种、2种,醛酮类物质3种、4种、5种,萜烯和C13-降异戊二烯2种、3种、3种,直链脂肪酸类仅在组别NDA21中检出1种。不同处理对赤霞珠桃红葡萄酒挥发性香气成分的影响差异较大,其中,组别D18+NDA21可提高萜烯类和C13-降异戊二烯类物质、醛酮类物质的总含量(526.1μg/L、1251.1μg/L),可明显提高β-大马士酮、丁酸乙酯、己酸乙酯和月桂酸乙酯的含量。
表2 不同赤霞珠桃红葡萄酒样品挥发性风味成分分析
Table 2 Volatile flavor components analysis in different Cabernet Sauvignon rose wine samples
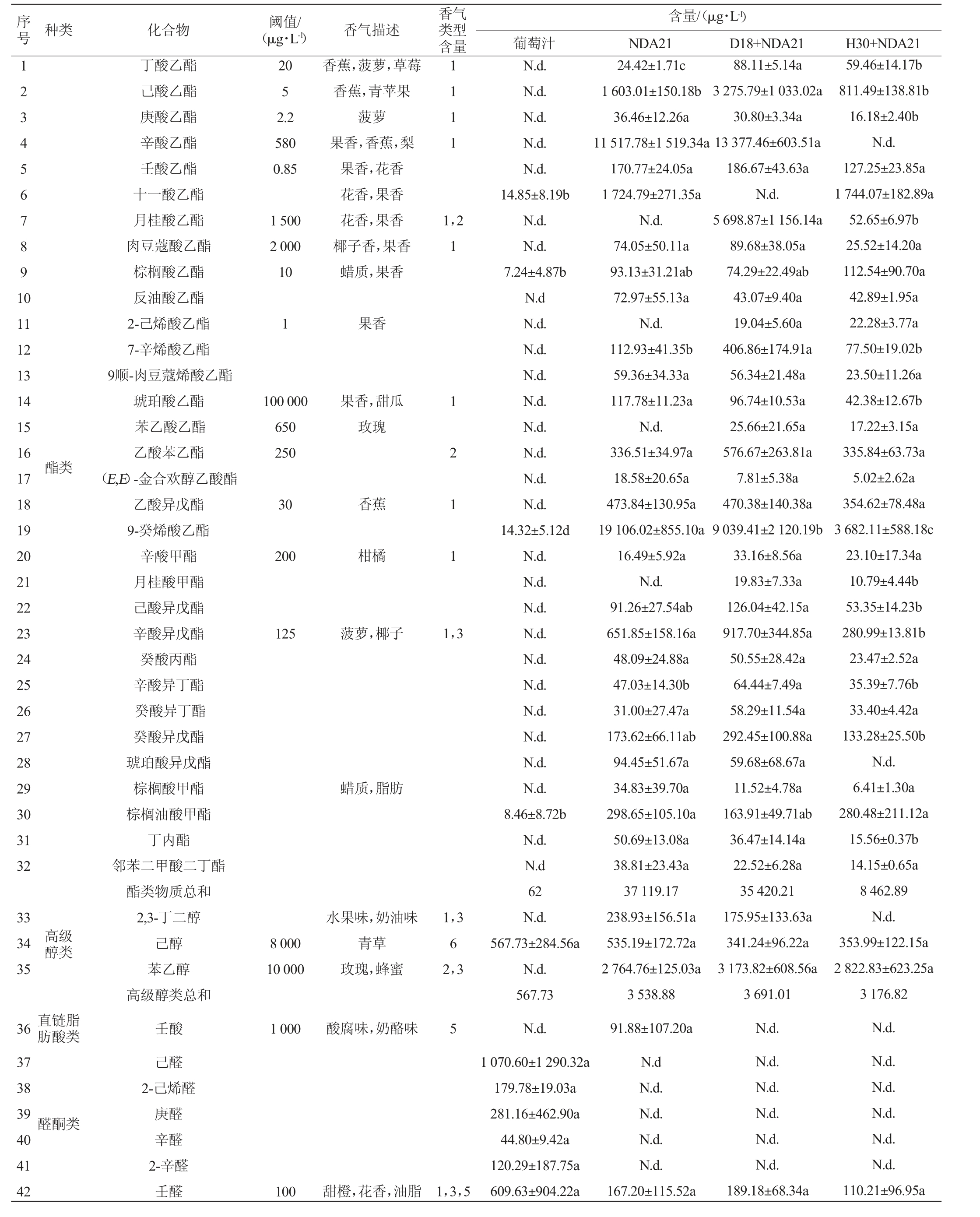
序号 种类 化合物 阈值/(μg·L-1) 香气描述香气类型含量含量/(μg·L-1)葡萄汁 NDA21 D18+NDA21 H30+NDA21 1 2 3 4 5 6 78 9 1 0 20 5 2.2 580 0.85 1 1 1 1丁酸乙酯己酸乙酯庚酸乙酯辛酸乙酯壬酸乙酯十一酸乙酯月桂酸乙酯肉豆蔻酸乙酯棕榈酸乙酯反油酸乙酯2-己烯酸乙酯7-辛烯酸乙酯9顺-肉豆蔻烯酸乙酯琥珀酸乙酯苯乙酸乙酯乙酸苯乙酯(E,E)-金合欢醇乙酸酯乙酸异戊酯9-癸烯酸乙酯辛酸甲酯月桂酸甲酯己酸异戊酯辛酸异戊酯癸酸丙酯辛酸异丁酯癸酸异丁酯癸酸异戊酯琥珀酸异戊酯棕榈酸甲酯棕榈油酸甲酯丁内酯邻苯二甲酸二丁酯酯类物质总和2,3-丁二醇己醇苯乙醇高级醇类总和壬酸己醛2-己烯醛庚醛辛醛2-辛醛壬醛1 500 2 000 10香蕉,菠萝,草莓香蕉,青苹果菠萝果香,香蕉,梨果香,花香花香,果香花香,果香椰子香,果香蜡质,果香1,2 1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 1果香100 000 650 250果香,甜瓜玫瑰酯类30香蕉200柑橘1 2 1 1 125菠萝,椰子1,3蜡质,脂肪33 34 35高级醇类8 000 10 000水果味,奶油味青草玫瑰,蜂蜜1,3 6 2,3 36 37 38 39 40 41 42直链脂肪酸类1 000酸腐味,奶酪味5醛酮类100甜橙,花香,油脂1,3,5 N.d.N.d.N.d.N.d.N.d.14.85±8.19b N.d.N.d.7.24±4.87b N.d N.d.N.d.N.d.N.d.N.d.N.d.N.d.N.d.14.32±5.12d N.d.N.d.N.d.N.d.N.d.N.d.N.d.N.d.N.d.N.d.8.46±8.72b N.d.N.d 62 N.d.567.73±284.56a N.d.567.73 N.d.1 070.60±1 290.32a 179.78±19.03a 281.16±462.90a 44.80±9.42a 120.29±187.75a 609.63±904.22a 24.42±1.71c 1 603.01±150.18b 36.46±12.26a 11 517.78±1 519.34a 170.77±24.05a 1 724.79±271.35a N.d.74.05±50.11a 93.13±31.21ab 72.97±55.13a N.d.112.93±41.35b 59.36±34.33a 117.78±11.23a N.d.336.51±34.97a 18.58±20.65a 473.84±130.95a 19 106.02±855.10a 16.49±5.92a N.d.91.26±27.54ab 651.85±158.16a 48.09±24.88a 47.03±14.30b 31.00±27.47a 173.62±66.11ab 94.45±51.67a 34.83±39.70a 298.65±105.10a 50.69±13.08a 38.81±23.43a 37 119.17 238.93±156.51a 535.19±172.72a 2 764.76±125.03a 3 538.88 91.88±107.20a N.d N.d.N.d.N.d.N.d.167.20±115.52a 88.11±5.14a 3 275.79±1 033.02a 30.80±3.34a 13 377.46±603.51a 186.67±43.63a N.d.5 698.87±1 156.14a 89.68±38.05a 74.29±22.49ab 43.07±9.40a 19.04±5.60a 406.86±174.91a 56.34±21.48a 96.74±10.53a 25.66±21.65a 576.67±263.81a 7.81±5.38a 470.38±140.38a 9 039.41±2 120.19b 33.16±8.56a 19.83±7.33a 126.04±42.15a 917.70±344.85a 50.55±28.42a 64.44±7.49a 58.29±11.54a 292.45±100.88a 59.68±68.67a 11.52±4.78a 163.91±49.71ab 36.47±14.14a 22.52±6.28a 35 420.21 175.95±133.63a 341.24±96.22a 3 173.82±608.56a 3 691.01 N.d.N.d.N.d.N.d.N.d.N.d.189.18±68.34a 59.46±14.17b 811.49±138.81b 16.18±2.40b N.d.127.25±23.85a 1 744.07±182.89a 52.65±6.97b 25.52±14.20a 112.54±90.70a 42.89±1.95a 22.28±3.77a 77.50±19.02b 23.50±11.26a 42.38±12.67b 17.22±3.15a 335.84±63.73a 5.02±2.62a 354.62±78.48a 3 682.11±588.18c 23.10±17.34a 10.79±4.44b 53.35±14.23b 280.99±13.81b 23.47±2.52a 35.39±7.76b 33.40±4.42a 133.28±25.50b N.d.6.41±1.30a 280.48±211.12a 15.56±0.37b 14.15±0.65a 8 462.89 N.d.353.99±122.15a 2 822.83±623.25a 3 176.82 N.d.N.d.N.d.N.d.N.d.N.d.110.21±96.95a
续表
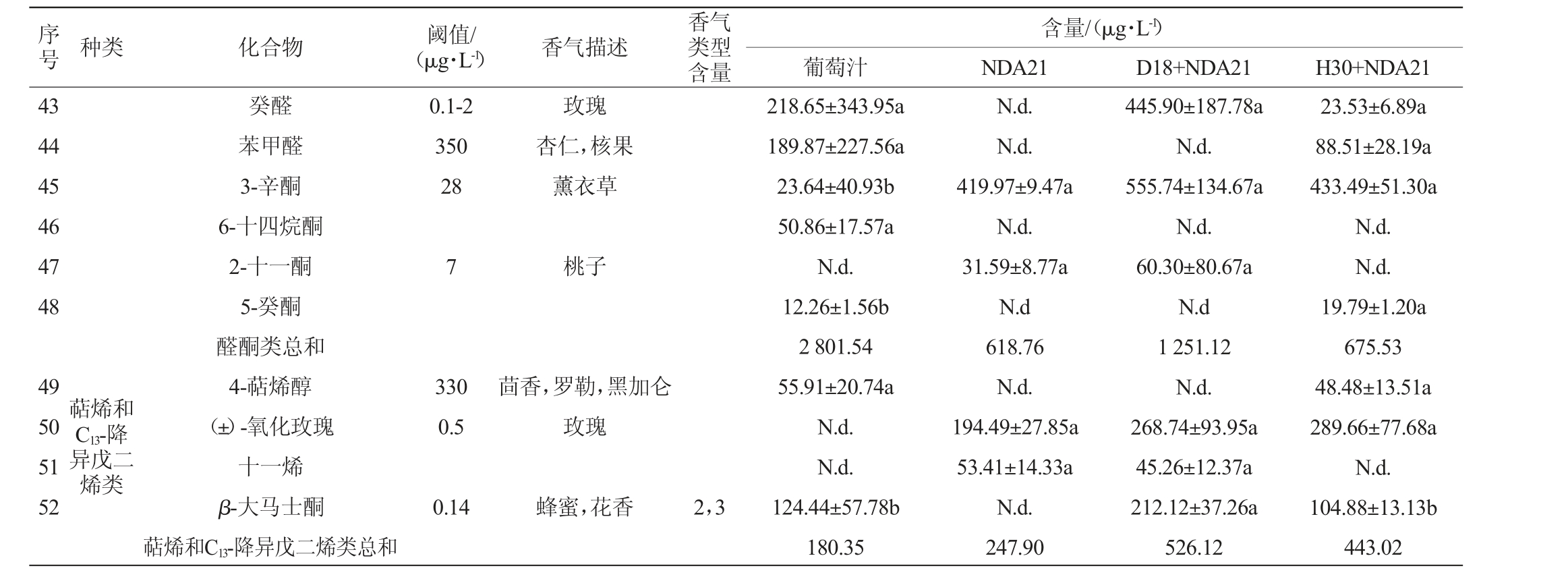
注:感官描述参考www.flavornet.org/flavornet.htmL;“b”1=果香,2=花香,3=甜香,4=化学味,5=脂肪味,6=植物味。
序号 种类 化合物 阈值/(μg·L-1) 香气描述香气类型含量含量/(μg·L-1)葡萄汁 NDA21 D18+NDA21 H30+NDA21 43 44 45 46 47 48 0.1-2 350 28玫瑰杏仁,核果薰衣草癸醛苯甲醛3-辛酮6-十四烷酮2-十一酮5-癸酮醛酮类总和4-萜烯醇(±)-氧化玫瑰十一烯β-大马士酮萜烯和C13-降异戊二烯类总和7桃子49 50 51 52萜烯和C13-降异戊二烯类330 0.5茴香,罗勒,黑加仑玫瑰0.14蜂蜜,花香 2,3 218.65±343.95a 189.87±227.56a 23.64±40.93b 50.86±17.57a N.d.12.26±1.56b 2 801.54 55.91±20.74a N.d.N.d.124.44±57.78b 180.35 N.d.N.d.419.97±9.47a N.d.31.59±8.77a N.d 618.76 N.d.194.49±27.85a 53.41±14.33a N.d.247.90 445.90±187.78a N.d.555.74±134.67a N.d.60.30±80.67a N.d 1 251.12 N.d.268.74±93.95a 45.26±12.37a 212.12±37.26a 526.12 23.53±6.89a 88.51±28.19a 433.49±51.30a N.d.N.d.19.79±1.20a 675.53 48.48±13.51a 289.66±77.68a N.d.104.88±13.13b 443.02
萜烯和C13-降异戊二烯类:此类化合物主要在葡萄果实发育过程中由乙酰辅酶A合成,具有较低的感官阈值,通常赋予葡萄酒优雅的花香和果味[23]。其中,组别D18+NDA21中β-大马士酮含量(212.12 μg/L)显著高于组别NDA21、H30+NDA21,组别D18+NDA21、H30+NDA21的OAV分别为1 515、749,赋予酒样蜂蜜、煮熟的苹果、鲜花等香气特征[2]。β-大马士酮的形成需要β-葡萄糖苷酶水解它的糖苷结合态前体物[3]。菌株D18具有高产β-葡萄糖苷酶的特点,酶活性显著高于H30[14],这一趋势与发酵组中β-大马士酮的浓度具有相似性。因此,高活性的β-葡萄糖苷酶是D18显著提升葡萄酒中β-大马士酮浓度的原因。不同组别葡萄酒样中(±)氧化玫瑰含量均较高,含量为194.49~289.66 μg/L(P>0.05),组别D18+NDA21、H30+NDA21的OAV分别为537.48、579.32,赋予清甜花香,似玫瑰和新鲜香叶[24],使酒样的花香特征更浓郁。组别D18+NDA21发酵组的萜烯类和C13-降异戊二烯类总含量分别为组别NDA21、H30+NDA21的2.1倍和1.2倍。有研究指出,高产β-葡萄糖苷酶的假丝酵母可以在麝香葡萄发酵中提升萜烯类和C13-降异戊二烯类的总量[15],与本实验结果相似。高产β-葡萄糖苷酶菌株参与发酵可以提升桃红葡萄酒萜烯类和C13-降异戊二烯类物质含量,其中,菌株D18对β-大马士酮的提升最为显著。
酯类:酯类是桃红葡萄酒中含量最丰富的香气化合物,属于二级香气[25]。酒样中共检出32种酯类物质,其中包括15种乙醇酯。乙醇酯是酒精发酵过程中酵母脂肪酸代谢产生的脂肪酸酰基辅酶A与乙醇反应生成[26]。各发酵组均检测到丁酸乙酯、己酸乙酯、壬酸乙酯、棕榈酸乙酯、乙酸苯乙酯、乙酸异戊酯、辛酸异戊酯(OAV均>1),具有明显的香气感知,同时这些香气在葡萄汁中未被检出。组别D18+DNA21中丁酸乙酯、己酸乙酯和月桂酸乙酯含量分别为88.1 μg/L、3 275.8 μg/L、5 698.9 μg/L,均显著高于其余发酵组。其中,丁酸乙酯能够带来更多的草莓、苹果、香蕉的香气[27],己酸乙酯具有红果的香气特征[28],月桂酸乙酯具有甜味、花香的香气特征[29]。辛酸乙酯(果香、甜味、茴香、蜡味)[30]在组别D18+NDA21、NDA21中含量较高,其OAV分别为23.06和19.85,但是在组别H30+NDA21中未检出。十一酸乙酯(呈花香、果香[31])在组别D18+NDA21中未检出,在其余发酵组中含量较高(1 724.79~1 744.07 μg/L)。9-癸烯酸乙酯(果香[32])在组别NDA21中含量最高(19 106.02 μg/L),显著高于其余组别。酵母中Eht1p酶和Eeb1p酶具有合成中链脂肪酸乙酯的能力和酯酶活性,是中链脂肪酸乙酯形成过程中最重要的酶[33]。非酿酒酵母D18次序发酵组的己酸乙酯和月桂酸乙酯含量普遍高于组别NDA21的原因可能是由于D18的Eht1p酶和Eeb1p酶活性高于NDA21。研究表明,优选本土非酿酒酵母NM218参与发酵显著提升了葡萄酒丁酸乙酯和己酸乙酯的含量,与本研究中D18在发酵中的表现一致[22]。酯类物质总含量最高是组别NDA21,为37 119 μg/L,与组别D18+NDA21的含量(35 420 μg/L)相近。在三个发酵组中,菌株D18参与葡萄酒发酵可以提高中链脂肪酸乙酯含量,可能提升葡萄酒的花香和果香。
醇类:高级醇是酵母由艾丽希途径(Ehrlich pathway)产生的,是酵母菌通过糖代谢或者氨基酸代谢的产物[31]。葡萄酒样中共检出3种醇类物质,分别为2,3-丁二醇、苯乙醇、己醇。除2,3-丁二醇在组别H30+DNA21未检出外,其余醇类物质在所有发酵组中均有检出,在组别NDA21、D18+NDA21中含量分别为238.93 μg/L、175.95 μg/L。其中,苯乙醇具有玫瑰和花粉的气味[27],非酿酒酵母参与发酵不影响葡萄酒高级醇含量。
醛酮类:酮类、醛类和缩醛类物质对葡萄酒香气的复杂性具有积极的影响[34]。葡萄酒样共检出12种醛酮类物质。其中OAV>1的挥发性风味物质有壬醛、3-辛酮、2-十一酮,其中,2-十一酮在组别H30+NDA21中未检出。癸醛在组别D18+NDA21中的含量(445.9 μg/L)显著高于其余组别,赋予酒样玫瑰的香气特征[35]。酒样中3-辛酮含量在发酵后提升,在发酵组酒样含量为419.97~555.74 μg/L(P>0.05),且OAV均>14。组别D18+NDA21的醛类和酮类总量是组别NDA21、H30+NDA21的2.0倍、1.9倍。非酿酒酵母D18参与发酵提升醛酮类物质的总含量。
2.2.2 主成分分析
选取OAV>0.1的27种挥发性风味成分,使用Origin 2018进行主成分分析(principal component analysis,PCA),结果见图2。由图2可知,第一主成分(PC1)方差贡献率为52.5%,第二主成分(PC2)方差贡献率为15.7%,第三主成分(PC3)方差贡献率为11.7%,累计方差贡献率达79.9%,其中,PC1中葡萄汁与发酵后的三组酒样分离且呈负相关,组别D18+NDA21与其他酒样区分开,位于PC1与PC2的正半轴区域。有6种酯类香气在PC1与PC2上与组别D18+NDA21均呈正相关性,除辛酸甲酯外,其余均为乙酯类香气物质,2-己酸乙酯、苯乙酸乙酯、癸酸乙酯、丁酸乙酯、辛酸乙酯,这些香气物质都具有果香,其中苯乙酸乙酯具有玫瑰气味[27],可能会改善酒样的感官特性。组别NDA21位于PC2的负半轴。组别D18+NDA21、H30+NDA21均位于PC2的正半轴,在PC3中仅组别H30+NDA21位于正半轴,与其余组别呈负相关。(±)-氧化玫瑰(16)、4-萜烯醇(13)等在PC3上与组别H30+NDA21呈正相关,(±)-氧化玫瑰具有花香[14],可能提升葡萄酒的感官品质。因此,基于挥发性风味物质的主成分分析可区分不同酒样。
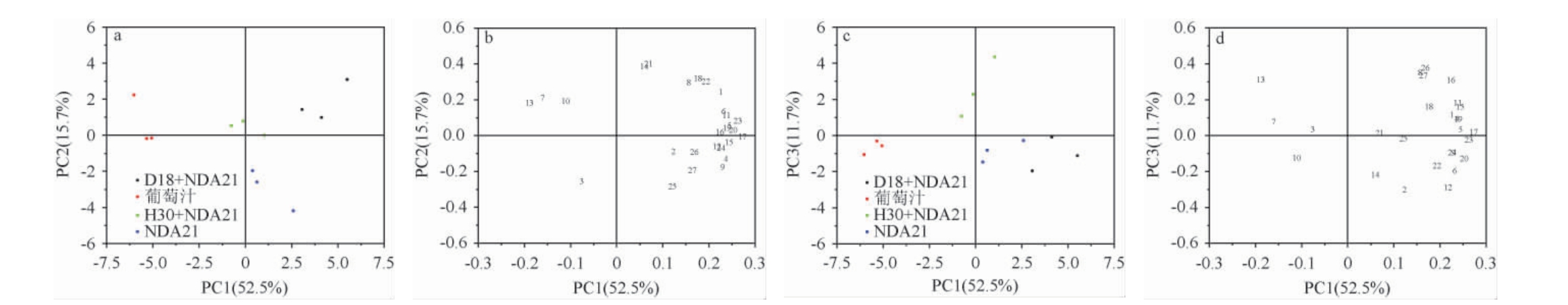
图2 赤霞珠桃红葡萄酒挥发性风味化合物主成分分析得分图(a,b)及载荷图(c,d)
Fig.2 Principal component analysis score diagram (a,b) and load chart (c,d) of volatile flavor components in Cabernet Sauvignon rose wine
不同颜色的点代表葡萄汁和葡萄酒样品。数字代表表中的挥发性风味成分:(1)丁酸乙酯,(2)2,3-丁二醇,(3)1-己醇,(4)乙酸异戊酯,(5)3-辛酮,(6)己酸乙酯,(7)苯甲醛,(8)2-己酸乙酯,(9)庚酸乙酯,(10)壬醛,(11)辛酸甲酯,(12)辛酸乙酯,(13)4-萜烯醇,(14)癸醛,(15)苯乙醇,(16)(±)-氧化玫瑰,(17)辛酸异丁酯,(18)苯乙酸乙酯,(19)苯乙酸乙酯,(20)辛酸异戊酯,(21)β-大马士酮,(22)癸酸乙酯,(23)癸酸异戊酯,(24)肉豆酸乙酯,(25)棕榈酸甲酯,(26)棕榈酸乙酯,(27)棕榈醇甲酯。
2.2.3 感官评价
葡萄酒样感官评价量化分析结果见图3。
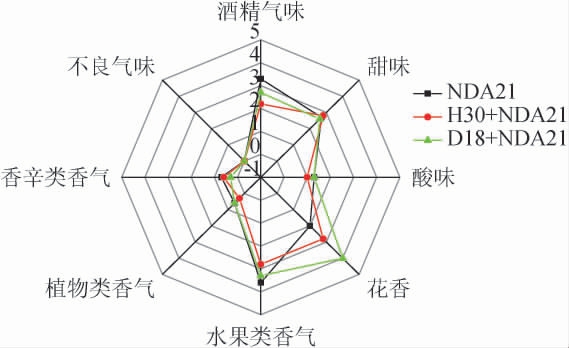
图3 葡萄酒样感官评价雷达图
Fig.3 Sensory evaluation radar map of wine samples
三个发酵组的综合评分排序为组别D18+NDA21(14.8分)>组别NDA21(14.2分)>组别H30+NDA21(12.5分)。这三款葡萄酒具有较强的花香以及水果类香气。组别D18+NDA21香气表现更为均衡,花香得分最高(4分),水果类香气与甜味评分较高(分别为3.3、1.3)。在主成分分析中,丁酸乙酯,己酸乙酯是组别D18+NDA21的特征香气,均具有花香和果香[30],这与感官品评的结果相一致。非酿酒酵母D18与酿酒酵母次序接种提升了桃红葡萄酒香气的复杂性和典型性。
3 结论
本研究结果表明,非酿酒酵母的添加可控制葡萄酒样中的总糖含量,显著降低酒石酸含量。其中,组别D18+NDA21的葡萄酒样检出挥发性风味物质种类最多(41种),其中,酯类31种、醇类3种、醛酮类4种、萜烯和C13-降异戊二烯3种;该组别可明显提高萜烯类和C13-降异戊二烯类物质、醛酮类物质的总含量,且β-大马士酮、丁酸乙酯、己酸乙酯和月桂酸乙酯含量较高。PCA可区分不同酒样,其中,组别D18+NDA21的葡萄酒样香气表现均衡,花香、果香和甜味突出。因此,菌株D18具有应用于优质桃红葡萄酒酿造的潜力。
[1]周鹤,张佳佳,时蒙蒙,等.冷浸渍时间和发酵温度对西拉桃红葡萄酒品质的影响[J].中国酿造,2022,41(6):178-183.
[2]ZHANG B Q,IVANOVA-PETROPULOS V,DUAN C Q,et al.Distinctive chemical and aromatic composition of red wines produced by Saccharomyces cerevisiae co-fermentation with indigenous and commercial non-Saccharomyces strains[J].Food Biosci,2021,41:100925.
[3]LIU J B,ZHU X L,ULLAH N,et al.Aroma glycosides in grapes and wine[J].J Food Sci,2017,82(2):248-259.
[4]夏俊芳,古丽娜孜,李璟瑜,等.“赤霞珠”葡萄自然发酵过程中高产β-葡萄糖苷酶酵母菌株筛选分析[J].食品工业科技,2020,41(13):134-140.
[5]KELANNE N M,SIEGMUND B,METZ T,et al.Comparison of volatile compounds and sensory profiles of alcoholic black currant(Ribes nigrum)beverages produced with Saccharomyces,Torulaspora,and Metschnikowia yeasts[J].Food Chem,2022,370:131049.
[6]HJELMELAND A K,EBELER S E.Glycosidically bound volatile aroma compounds in grapes and wine:A review[J].Am J Enol Vitic,2015,66(1):1-11.
[7]LOSCOS N,HERNANDEZ-ORTE P,CACHO J, et al.Release and formation of varietal aroma compounds during alcoholic fermentation from nonfloral grape odorless flavor precursors fractions[J].J Agr Food Chem,2007,55(16):6674-6684.
[8]HAN X Y, QIN Q X, LI C Y, et al.Application of non-Saccharomyces yeasts with high β-glucosidase activity to enhance terpene-related floral flavor in craft beer[J].Food Chem,2023,404:13472.
[9]SU H,XIAO Z,YU K,et al.Use of a purified β-glucosidase from coralassociated microorganisms to enhance wine aroma[J].J Sci Food Agr,2022,102(8):3467-3474.
[10]HUANG R,ZHANG F,YAN X,et al.Characterization of the β-glucosidase activity in indigenous yeast isolated from wine regions in China[J].J Food Sci,2021,86(6):2327-2345.
[11]SU Y, DONG Q A, CHEN Y, et al.Impact of sequential inoculation timing on the quality of wine fermented by indigenous Lachancea thermotolerans and Saccharomyces cerevisiae[J].LWT-Food Sci Technol,2024,204:116438.
[12]ZHAO Y,SUN Q Y,ZHU S S,et al.Biodiversity of non-Saccharomyces yeasts associated with spontaneous fermentation of Cabernet Sauvignon wines from Shangri-La wine region,China[J].Sci Rep,2021,11(1):5150.
[13]覃秋杏,韩小雨,黄卫东,等.非酿酒酵母产生的β-葡萄糖苷酶在发酵酒中的应用研究进展[J].食品科学,2022,43(3):306-314.
[14]青鑫.高β葡萄糖苷酶活性酵母的筛选及其对葡萄酒香气的影响[D].北京:中国农业大学,2019.
[15]HAN X Y, QING X, YANG S Y, et al.Study on the diversity of non-Saccharomyces yeasts in Chinese wine regions and their potential in improving wine aroma by 8-glucosidase activity analyses[J].Food Chem,2021,360:129886.
[16]SUN X Y,ZHAO Y,LIU L L,et al.Copper tolerance and biosorption of Saccharomyces cerevisiae during alcoholic fermentation[J].Plos One,2015,10(6):128611.
[17]RUIZ-DE-VILLA C,GOMBAU J,POBLET M,et al.Sequential inoculation of Torulaspora delbrueckii and Saccharomyces cerevisiae in rosé wines enhances malolactic fermentation and potentially improves colour stability[J].LWT-Food Sci Technol,2023,190:115540.
[18]CHEN D, CHIA J Y, LIU S Q.Impact of addition of aromatic amino acids on non-volatile and volatile compounds in lychee wine fermented with Saccharomyces cerevisiae MERIT.ferm[J].Int J Food Microbiol,2014,170:12-20.
[19]IVIT N N,LONGO R,KEMP B.The effect of non-Saccharomyces and Saccharomyces non-cerevisiae yeasts on ethanol and glycerol levels in wine[J].Fermentation,2020,6(3):77.
[20]钟轲,丁燕,汤晓宏,等.不同海拔高度和品种对脐橙酒香气组成及感官品质的影响[J].中国酿造,2023,42(10):100-107.
[21]ZAGRODZKI P, JANCIK M, PI  TEK W, et al.Changes in selected chemical and sensory parameters during aging of red wines produced in Poland.[J].Eur Food Res Technol,2023,249(7):1915-1924.
TEK W, et al.Changes in selected chemical and sensory parameters during aging of red wines produced in Poland.[J].Eur Food Res Technol,2023,249(7):1915-1924.
[22]王燕,李德美,孙智文,等.不同产区赤霞珠干红葡萄酒非挥发风味物质的差异性分析[J].中国酿造,2021,40(4):72-76.
[23]高娉娉.高产β-葡萄糖苷酶本土优良非酿酒酵母菌株筛选及应用效果评价[D].兰州:甘肃农业大学,2022.
[24]王勇,孙锋,李玉玲,等.27份葡萄品种资源香味性状鉴定研究[J].植物遗传资源学报,2023,24(5):1355-1366.
[25]战吉宬,曹梦竹,游义琳,等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学,2020,53(19):4057-4069.
[26]LAI Y T,HOU C Y,LIN S P,et al.Sequential culture with aroma-producing yeast strains to improve the quality of Kyoho wine[J].J Food Sci,2023,88(3):1114-1127.
[27]马娜,王星晨,孔彩琳,等.胶红酵母与酿酒酵母共发酵对干红葡萄酒香气与色泽的影响[J].食品科学,2021,42(2):97-104.
[28]胡瑞祺,杨薇熹,凌梦琪,等.贺兰山东麓产区地块间‘赤霞珠’和‘马瑟兰’葡萄酒香气差异分析[J].中国酿造,2024,43(6):49-58.
[29]王芯媛.高HCDC酶活酵母的筛选及其改善桑椹酒花色苷稳定性的作用研究[D].北京:中国农业大学,2021.
[30]张娟,田旭,贾毅男,等.发酵后排籽浸渍对西拉干红葡萄酒香气成分及感官品质的影响[J].中国酿造,2023,42(7):221-227.
[31]郭静娴,谢涵,华玉波,等.不同酵母对赤霞珠桃红葡萄酒香气的影响[J].中国酿造,2021,40(4):50-55.
[32]尹荐,陶永胜,孙玮璇,等.优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J].农业工程学报,2020,36(4):278-286.
[33]胡文效,姚彬彬,陈明光,等.葡萄酒中链脂肪酸乙酯产生机制与调控策略探讨[J].中外葡萄与葡萄酒,2023(3):73-79.
[34]马腾臻,宫鹏飞,史肖,等.红枣发酵酒香气成分分析及感官品质评价[J].食品科学,2021,42(4):247-253.
[35]王陶,徐姿静,张文学,等.三个品种猕猴桃贵腐酒的香气特征分析[J].中国酿造,2023,42(1):65-71.