酱香型白酒因其幽雅的酱香和细腻口感深受消费者喜爱,高温堆积发酵是酱香型白酒区别于其他香型白酒的最主要的关键工艺之一。在堆积过程中,酒醅中的微生物增殖、扩培为后续糖化和窖内发酵提供动力[1],同时在堆积过程中,微生物的代谢发酵生成丰富的酶类、风味物质及其前体物质,促进酒醅发酵生香[2],被称为“二次制曲”。高温堆积工艺包括起堆、接堆、丢堆、整堆和堆积发酵五个部分,其中丢堆工艺是酒醅在完成摊晾、拌曲工序后按照四面一层盖一层、疏松透气、无醅团、无压堆的要求进行起堆,起堆后进行一定时间的接堆,直到最后一排曲糟醅接堆的全过程。丢堆完成后按照工艺参数进行堆积发酵,一般酒醅堆积到顶温达45~55 ℃左右,堆积发酵结束[3]。目前针对堆积发酵的研究主要集中在堆积过程中的酒醅物料特性变化[4]、微生物群落演替[5-6]、风味物质形成[7-8]及相应的工艺参数研究[3]。丢堆也是堆积发酵环节的重要工序之一,丢堆操作需要控制酒醅的糊化程度及温度、丢堆的时间,防止堆积过程发酵异常[9]。但是目前对堆积发酵过程中丢堆工艺的研究尚鲜有报道,不同丢堆时间对堆积发酵的影响尚不清晰,这制约了酱香型白酒堆积发酵的管理和控制。因此,解析酱香型白酒丢堆工艺对堆积发酵过程的影响是探究堆积发酵机理、控制白酒质量必不可少的环节。
本研究旨在对比不同丢堆时间工艺条件下,酱香型白酒二轮次堆积发酵过程酒醅的温度变化、理化特性、微生物代谢以及酒体风味差异,明确不同丢堆时间对酱香型白酒堆积发酵的影响,为白酒智能酿造过程中堆积工艺控制提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品收集
酒醅取自二轮次堆积发酵生产过程。对照组采用常规时间丢堆即2天起一个堆,选取8个堆子,编号为JPND1~JPND8;实验组增加丢堆时间即3天起一个堆,选取8个堆子,编号为JPTD1~JPTD8。采用5点取样法,均匀围绕堆子设计5个取样点,于深度15 cm处每个点取样100 g并混匀。每个堆子对应的基酒样品分别编号,对照组为ND1~ND8,实验组为TD1~TD8。
1.1.2 化学试剂
0.1%吕氏碱性美蓝染色液、酚酞、氯化钠、氢氧化钠、酒石酸钾钠(均为分析纯):国药集团化学试剂有限公司;乙醛、乙缩醛、甲醇、仲丁醇、正丙醇、乙酸异戊酯、戊酸乙酯、糠醛、丙酸等24种标准物质(均为色谱纯):天津市光复精细化工研究所。
1.2 仪器与设备
CX43 电子显微镜:美国奥林巴斯公司;AB204-S精密电子天平:METTLER TOLEDO国际贸易(上海)有限公司;Trace 1300气相色谱(gas chromatography,GC)仪、Trace 1300-ISQ气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:ThermoFisher Scientific公司。
1.3 测定方法
1.3.1 堆积发酵过程中酒醅温度的测定
在距离堆积表层10~15 cm、50~60 cm、90~100 cm、140~145 cm处设置温度传感器,从丢堆结束直至堆积结束,每天收集一次温度,跟踪堆积发酵过程不同深度的温度变化情况。
1.3.2 堆积结束后酒醅理化指标的测定
水分含量:参考GB 5009.3—2016《食品中水分的测定》[10]检测;酸度、还原糖、淀粉含量:参考DB 34/T 2264—2014《固态发酵酒醅分析方法》[11]检测。
1.3.3 堆积结束后酒醅菌体数量和酵母活菌率
总真菌和总细菌数:采用平板涂布的方法测定,总细菌用营养琼脂(nutrient agar,NA)培养基,总真菌用孟加拉红培养基,分别于36 ℃和30 ℃培养箱中培养24 h后检测菌落总数。
酵母菌活菌率:采用美蓝染色法[12]测定。称取10 g酒醅置于锥形瓶中,加入90 mL无菌水,振荡15 min,取1 mL菌悬液,1 000 r/min离心5 min,经美蓝染色后置于显微镜中读取酵母活菌数。
1.3.4 酒体中总酸、总酯检测
酒体的总酸、总酯含量参照GB/T 10345—2022《白酒分析方法》测定[13]。
1.3.5 酒体挥发性风味物质检测
酒体挥发性风味物质的检测采用顶空固相微萃取技术(headspace-solid phase micro extraction,HS-SPME)结合气相质谱联用(GC-MS)技术[14]。
挥发性风味物质的提取:准确量取2.5 mL酒样,7.5 mL超纯水置于20mL顶空进样瓶中,并加入50μL2-乙基丁酸内标溶液(0.95 g/L),2 g氯化钠,将顶空进样瓶密封,在50 ℃、300 r/min平衡10 min;将老化好的萃取头插入顶空瓶中,恒温萃取40 min后取出纤维头,插入GC进样口,解吸5 min。
GC条件:HP-FFAP色谱柱(30 m×0.25 mm,0.25 μm);进样口温度200 ℃;分流比50∶1;载气为高纯氦气(He);升温程序:起始温度37 ℃,保持9 min,以3 ℃/min升温至45 ℃,再以10 ℃/min升温至100 ℃,保持4 min,再以15 ℃/min升温至180 ℃,保持5 min,再以5 ℃/min升温至200 ℃,保持4.5 min,总运行时间40 min。
MS条件:电子电离(electron ionization,EI)源;电子能量70 eV;离子源温度250 ℃;传输线温度250 ℃;扫描模式为全扫描;质量扫描范围30~550 m/z。
定性定量方法:运用美国国家标准技术研究所(national institute of standards and technology,NIST)谱库进行初步检索及资料分析,再结合文献的保留指数(retention index,RI)对化合物进行定性。采用内标法进行定量分析。
1.3.6 数据处理与统计分析
采用R软件(R-4.4.0)进行样本间差异分析和相关分析(P<0.05)。采用Origin 2021进行绘图,实验结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同丢堆时间对堆积发酵过程温度的影响
温度是评价高温堆积发酵状态的重要指标,堆积过程中升温过快会导致酿酒微生物繁殖异常,酵母数量偏低;升温过慢容易滋生霉菌,影响基酒的产质量[15]。为了探究不同丢堆时间对堆积温度的影响,对不同丢堆时间下的堆积发酵过程的温度进行了监测,堆积发酵过程不同深度酒醅的温度变化趋势如图1所示。
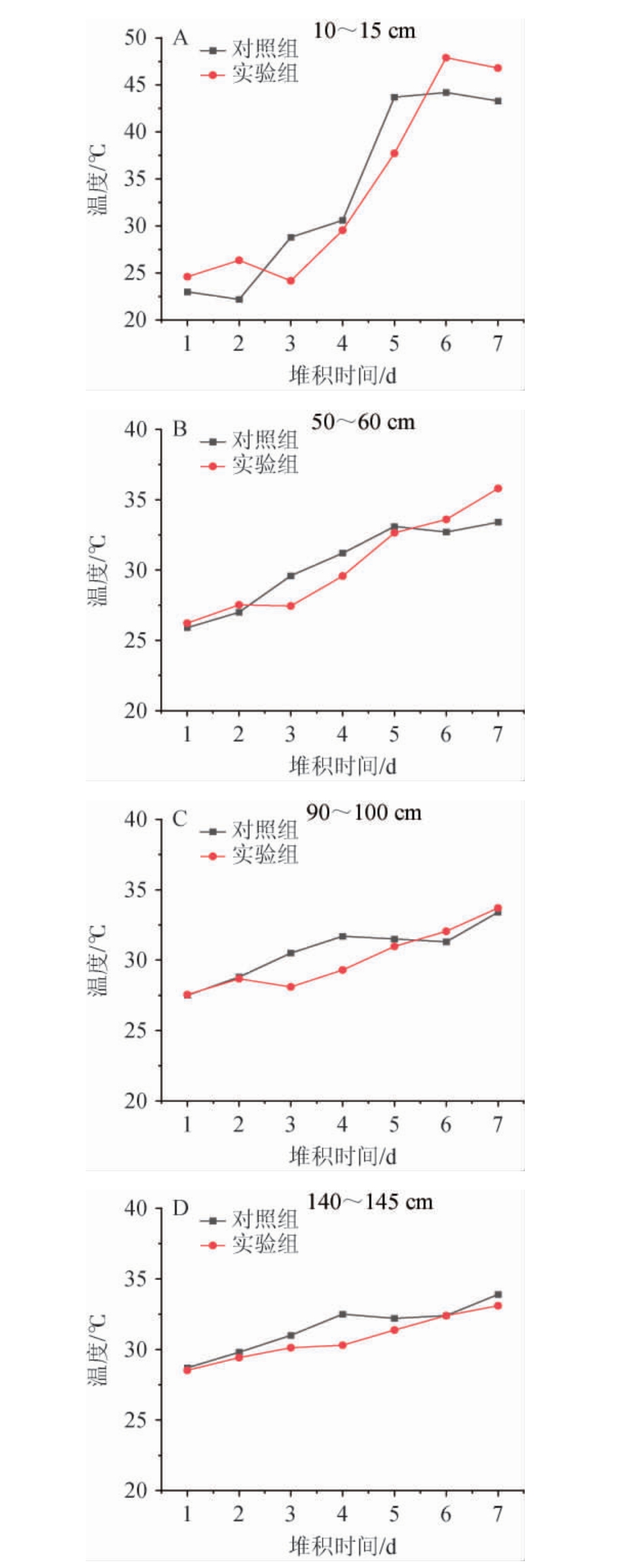
图1 不同丢堆时间下堆积发酵过程不同深度酒醅的温度变化趋势
Fig.1 Temperature changes in Jiupei at various depths during fermentation with different stacking time
由图1A、图1B可知,堆子外层(10~15 cm处及50~60 cm处)酒醅温度变化幅度最大,温度变化整体呈“S”型曲线,变化趋势分为3个阶段:第一个阶段为缓慢升温期,对照组在堆积第1~2天,温度变化缓慢,堆子外层酒醅温度低于25 ℃,堆积第2天后进入快速升温期;实验组在堆积第1~3天出现相同的趋势,堆积第3天后进入快速升温期。总而言之,在堆积开始阶段即在缓慢升温期,对照组堆子外层的温度低于实验组堆子外层的温度,但延长丢堆时间后,增加了缓慢升温期的持续时间。第二个阶段为堆积中期(快速升温期),对照组堆积第2天后堆积外层酒醅温度快速上升,至堆积第5天达到43.7 ℃;实验组堆积第3天后酒醅温度快速上升,至堆积第6天达到47.9 ℃。第三个阶段为堆积结束时期(缓慢回落期),对照组在堆积第6天达到最高温44.2 ℃,随后温度基本维持在最高温度附近,并在入窖前略有降低;实验组呈现相同趋势,实验组温度显著高于对照组的温度。由图1C、图1D可知,堆子深层(90~100 cm处及140~145 cm处)酒醅发酵温度变化幅度较小,温度逐渐升高,在堆积中期,实验组的温度低于对照组温度,其他阶段温度差异不显著。堆积发酵外层酒醅温度的“S”形曲线与微生物生长曲线趋势一致,说明酒醅升温过程与微生物的生长繁殖密切相关;而内层酒醅温度变化并未呈现相似规律,这可能是由于内层酒醅的溶氧环境不足以支撑微生物的快速繁殖。涂昌华等[16]研究发现,堆积发酵酒醅温度由内向外逐渐升高,表层酒醅温度变化呈“S”型曲线。
结果表明,不同丢堆时间下堆积过程酒醅的温度变化趋势一致,延长丢堆时间主要影响堆积外层(10~15 cm处)酒醅的温度变化。延长丢堆时间使得外层酒醅的快速升温阶段开始时间延后且使得堆积顶温提高。
2.2 不同丢堆时间对酒醅理化指标的影响
“酸、糖、水、淀”是反映酒醅发酵状态的重要理化指标,对于酿酒生产指导和白酒发酵过程质量的控制发挥着不可替代的作用[17]。适宜的水分保障了微生物的生长代谢,并为其代谢产物(醇、醛、酸、酯等)提供了反应基质[18]。有机酸不仅是白酒风味的重要组成部分,还能调控微生物的生长代谢。适宜的酸可以抑制部分有害杂菌的生长繁殖[19];同时可以提供有益微生物生长所需的营养物质并生成酒中有益的香味物质[20]。为了探究不同丢堆时间对酒醅堆积发酵状态的影响,对堆积结束时酒醅的基本理化指标进行检测,结果如图2所示。
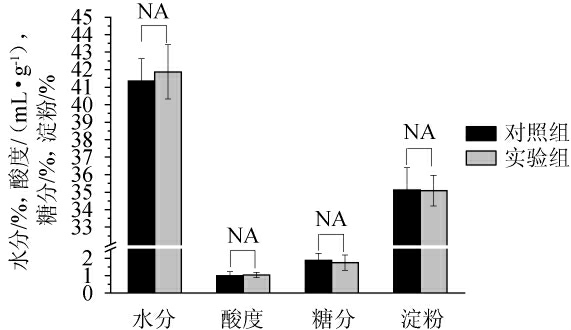
图2 不同丢堆时间酒醅堆积结束后基本理化指标差异
Fig.2 Differences of basic physicochemical indexes of Jiupei at different stacking time
“NA”表示无显著差异(P>0.05)。
由图2可知,对照组入窖酒醅的水分含量[(41.35±1.28)%]与酸度[(1.01±0.21)%]均低于实验组[(41.87±1.55)%;(1.04±0.16)%],差异不显著(P>0.05)。酸度过低会造成堆积和窖内发酵升温过快,导致后期升酸幅度增大,容易造成酒醅中营养物质的消耗,不利于发酵质量和基酒质量的控制。在发酵过程中,酒醅中的淀粉被转化为微生物可以直接利用的还原糖,进而被酵母发酵生成酒精。窖池内酒醅中的淀粉和还原糖是酒精发酵的物质基础。对照组入窖酒醅的还原糖[(1.88±0.40)%]与淀粉[(35.12±1.28)%]均高于实验组[(1.75±0.44%);(35.08±0.88)%],差异不显著(P>0.05)。这可能是由于延长起堆时间,为微生物的生长繁殖提供了足够的氧气和充足的时间,促进了微生物的代谢,消耗了更多的糖分同时代谢产生了更多水分和有机酸。综上结果表明,延长丢堆时间对酒醅理化指标无显著影响。
2.3 不同丢堆时间对微生物的影响
白酒生产是一个微生物此消彼长、多种微生物共同发酵的过程,在优势微生物的主导下,各种微生物共同参与发酵,才能获得更高品质的白酒。酱香型白酒堆积过程中的微生物种类繁多,数量巨大,白酒的产质量与微生物的数量和种类息息相关。入窖酒醅的总细菌和总真菌数反映了酒醅中微生物的整体数量,是酒醅发酵状态的重要体现[21]。为了探究不同丢堆时间对酒醅发酵状态的影响,对堆积结束时入窖酒醅的总细菌及总真菌进行了检测,结果发现,对照组入窖酒醅中的总细菌和总真菌的数量分别为9.47×106 CFU/g、5.38×106 CFU/g;延长丢堆时间后入窖酒醅中的总细菌和总真菌分别为1.62×107CFU/g、1.32×107CFU/g,显著高于对照组的总细菌及总真菌数量(P<0.05)。即延长丢堆时间能显著的增加酒醅中的总细菌和总真菌。酵母菌则是发酵产乙醇和产高级酯类的重要动力来源,实验同时跟踪了不同丢堆时间下堆积结束的酒醅的酵母活菌率。实验结果表明,对照组入窖酒醅的酵母活菌率[(71.39±9.72)%]低于实验组[(77.05±10.63)%],说明延长丢堆时间有利于为窖内发酵提供更有活力的酵母菌群。综上结果,延长丢堆时间会显著影响微生物的富集情况,适当的延长丢堆时间有助于增加入窖酒醅的微生物数量,为下一步的窖内发酵提供微生物动力。
2.4 不同丢堆时间对基酒总酸、总酯及风味物质的影响
2.4.1 基酒总酸及总酯含量
总酸和总酯是基酒质量和入库分级的重要参考指标[22]。酱香型白酒具有“酸高酯高”的特点,白酒中的有机酸是重要呈味组分,赋予白酒醇厚、丰满的口感;同时有机酸的存在可以消除白酒的苦味使白酒的味觉发生转变,提高白酒品质[23];酯类物质是白酒中重要的呈香物质,通常呈现水果香,赋予白酒愉悦舒适的香气,对白酒的香气起着调节作用[24]。酸与酯共同作用,起着协调平衡白酒酒体的作用,从而确保酒体的质量稳定[25]。通过测定不同丢堆方式下处理的基酒的总酸、总酯含量,结果发现,实验组的总酸[(2.89±0.53)g/L]、总酯[(6.60±0.67)g/L]含量高于对照组[(2.76±0.24)g/L;(6.19±0.58)g/L],表明适当延长丢堆时间有利于提升酒体质量。
2.4.2 基酒挥发性风味物质
白酒独特的风味与其化学成分密切相关,白酒中数量众多且组成不同的酸类、酯类和醇类等挥发性风味物质赋予了白酒不同的香气和口味,共同决定了酒体的风格和质量等级。实验通过HS-SPME与GC-MS联用对两种丢堆方式生产的基酒的24种挥发性风味物质进行了检测和分析。基于挥发性风味物质定量结果建立不同丢堆时间下基酒的偏最小二剩判别分析(partial least squares discriminant analysis,PLS-DA)分类模型,对挥发性风味物质进行可视化分析,结果见图3。由图3可知,对照组和实验组样品可以明显分开,模型分类效果良好,说明两组样品间挥发性风味物质存在差异。
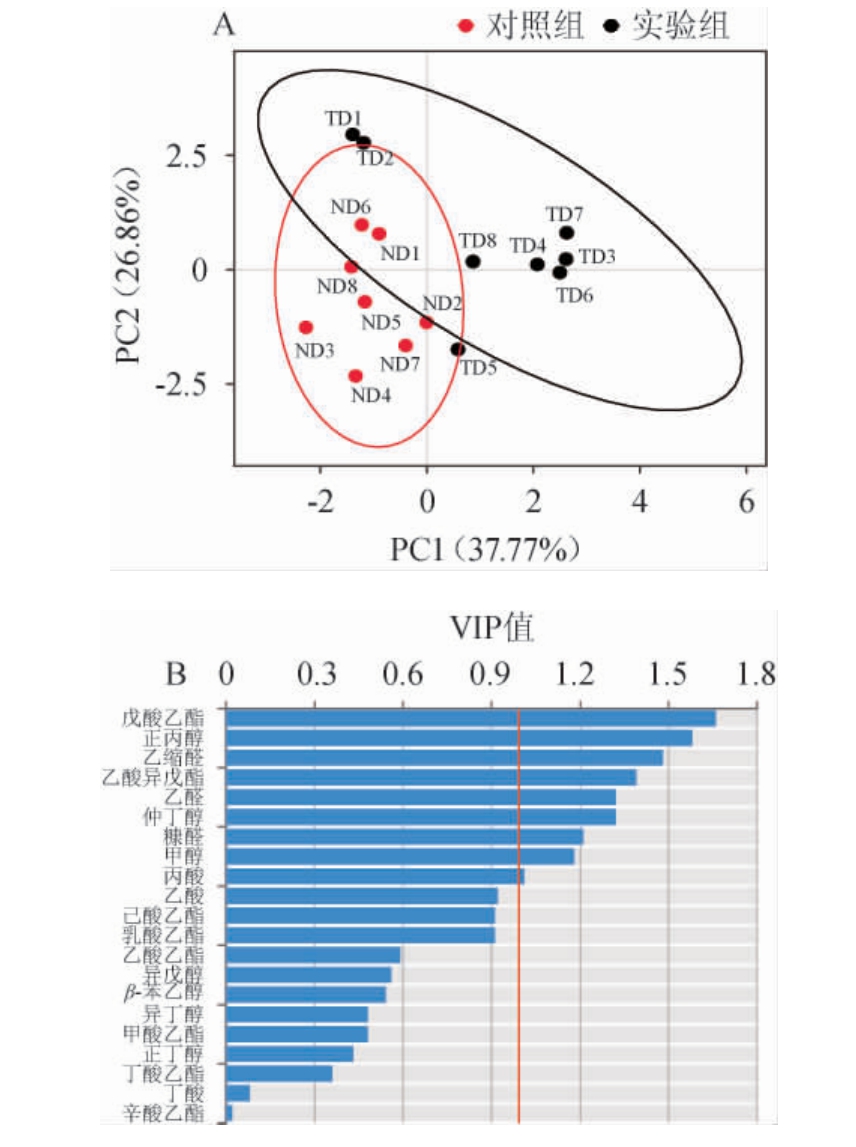
图3 基于挥发性风味物质不同丢堆时间处理下基酒偏最小二乘判别分析(A)及变量投影重要性值(B)
Fig.3 Partial least squares discriminant analysis (A) and variable importance in the projection values(B)in base liquor at different stacking time based on volatile flavor compounds
为了研究两组基酒的差异挥发性风味物质,以变量投影重要性(variable importance in projection,VIP)值>1为指标[26],确定对基酒区分有重要贡献的挥发性风味物质9种,包括戊酸乙酯、正丙醇、乙缩醛、乙酸异戊酯、乙醛、仲丁醇、糠醛、甲醇和丙酸。其中戊酸乙酯(VIP值=1.66)、正丙醇(VIP值=1.58)和乙缩醛(VIP值=1.485)为重要影响因子。戊酸乙酯具有类似菠萝、水蜜桃的香气,有助于提高酒体的陈味[27]。正丙醇微苦,是一种高级醇,能够衬托酒体酯类香气[28]。乙缩醛的主要功能表现为对白酒香气的平衡作用,赋予酒体青草香、水果香[29]。
为了进一步研究不同丢堆时间对酱香型白酒基酒关键香气化合物的影响,采用聚类分析并结合热图的方式直观展示了9种重要挥发性风味物质的分布规律,结果见图4。颜色由黄到绿表示相对含量由低到高的变化。由图4可知,对照组的乙醛、乙缩醛高于实验组,乙醛、乙缩醛是白酒中重要的醛类风味物质,适量的乙醛和乙缩醛可以赋予白酒舒适的青草香,是酱香型白酒生木香的重要组成因素。其他重要挥发性风味物质(醇类、酯类、酸类)含量实验组均高于对照组,说明延长丢堆时间可增加部分挥发性风味物质的含量。酱香型白酒基酒关键挥发性风味物质的差异形成了酒体风格的差异,进一步验证了丢堆时间的改变显著影响堆积与窖内发酵过程。
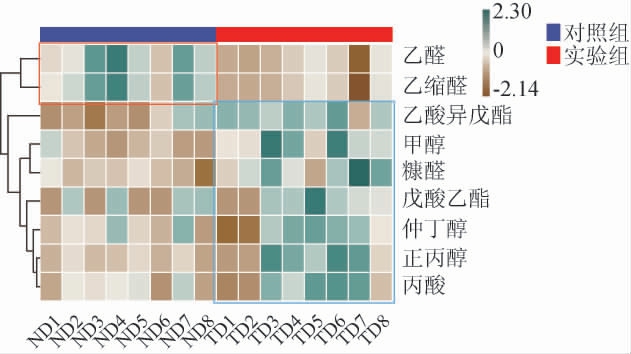
图4 不同丢堆时间下关键风味物质含量分布及聚类结果
Fig.4 Content distribution and clustering results of key flavor substances with different stacking time
3 结论
本研究对比分析了不同丢堆时间对酱香型白酒堆积发酵的影响。延长丢堆时间使外层酒醅的快速升温阶段开始时间延后,提高了堆积顶温。延长丢堆时间能增加酒醅中的总细菌数、总真菌数和酵母菌活菌率。同时不同丢堆方式生产的基酒在关键风味物质含量方面存在差异,延长丢堆方式可以增加基酒的总酸、总酯含量,有利于提升基酒质量。然而,堆积发酵是一个极其复杂的过程,后续将进一步开展智能酿造过程中酒醅温度、理化特性和关键微生物之间的关联性分析,实现酿造过程的精细化控制,为智能酿造的质量控制和品质提升提供科学支撑。
[1]周恒刚.酱香型白酒生产工艺的堆积[J].酿酒科技,1999(1):5-7.
[2]GUAN T W,YANG H,OU M Y,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2020,139:1096-1127.
[3]杨磊,余辉,罗南海,等.酱香型白酒高温堆积发酵工艺创新研究回顾与展望[J].中国酿造,2024,43(2):15-21.
[4]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44(2):240-247.
[5]张红霞,徐岩,杜海.酱香型白酒堆积发酵过程中真菌的结构及其来源分析[J/OL].食品与发酵工业:1-10[2024-04-30].https://doi.org/10.13995/j.cnki.11-1802/ts.037910.
[6]李景辉,郭莹,张颖,等.高产酯菌株的筛选及其在酱香型白酒堆积发酵中的应用[J].中国酿造,2021,40(10):168-173.
[7]李喆,冯海燕,吴德光,等.酱香型白酒堆积发酵过程中不同空间位置酒醅差异性比较[J].中国酿造,2023,42(3):58-64.
[8]张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.
[9]王贵军,沈才洪,张洪远,等.酱香型白酒酒醅堆积与窖内发酵工艺研究[J].酿酒科技,2011(5):36-37,41.
[10]国家卫生和计划生育委员会.GB 5009.3—2016 食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2016.
[11]安徽省质量技术监督局.DB 34/T 2264—2014 固态发酵酒醅分析方法[S].合肥:安徽人民出版社,2014.
[12]陈兴民,刘军,李建国,等.酵母菌的分离培养及发酵实验方法[J].生物学通报,2016,51(5):43-44,64.
[13]国家市场监督管理总局,国家标准化管理委员会.GB/T 10345—2022白酒分析方法[S].北京:中国标准出版社,2023.
[14]唐平,卢君,毕荣宇,等.赤水河流域不同地区酱香型白酒风味化合物分析[J].食品科学,2021,42(6):274-281.
[15]游玲,聂骊锟,石晓东,等.温度对芝麻香白酒堆积发酵的影响[J].食品与发酵工业,2015,41(9):69-73.
[16]涂昌华,郝飞,汪地强,等.酱香型白酒下沙、造沙轮次堆积发酵过程中酒醅温度与微生物的变化规律分析[J].酿酒科技,2020(2):60-64.
[17]WU C,HU J F,WANG D Q,et al.Comparison of physicochemical parameters,microbial community composition and flavor substances during mechanical and traditional brewing process of Jiang-flavor Baijiu[J].Food Sci Biotechnol,2024,33(8):1909-1919.
[18]FU G M,DENG M F,CHEN Y,et al.Analysis of microbial community,physiochemical indices, and volatile compounds of Chinese Te-flavor Baijiu Daqu produced in different seasons[J].J Sci Food Agr,2021,15(101):6525-6532.
[19]HUANG Z J,ZENG Y H,LIU W H,et al.Effects of metals released in strong-flavor Baijiu on the evolution of aroma compounds during storage[J].Food Sci Technol,2020,5(4):1904-1913.
[20]WANG M Y,YANG J G,SU C,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,1(84):6-18.
[21]王晓丹,庞博,陆安谋,等.酱香型白酒堆积过程中酵母变化趋势研究[J].食品工业,2014,35(12):42-44.
[22]苏鹏飞,朱瑞雪,金成勇,等.凤香型原酒总酸和总酯指标快检技术的开发[J].酿酒,2023,50(3):110-112.
[23]贾巧唤,任石苟.浅述酸、酯、醇等成分对白酒的影响[J].食品工程,2008(4):12-13.
[24]李莉,王秋叶,盛夏,等.白酒中酯类对酒质的影响[J].食品安全导刊,2016(36):124.
[25]郭世鑫,张小娜,姚孟琦,等.不同工艺酱香型白酒成分分析[J].食品与发酵工业,2022,48(1):241-246.
[26]熊月丰,陈山乔,陶佳佳,等.LC-MS结合代谢组学技术鉴定真假白酒的研究[J].食品工业科技,2016,37(9):331-334,392.
[27]范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社,2019:25-27.
[28]卢建军,杨帆,杨婧,等.白酒酿造中产正丙醇的微生物溯源研究[J].中国酿造,2019,38(7):151-155.
[29]黄跃勇,张国强,孙靖茹.新蒸馏白酒贮存过程中乙醛和乙缩醛的变化[J].酿酒,2009,36(3):25-26.