茄腐镰刀菌(Fusarium solani)作为一种广泛分布的土传病原菌,对全球农业生产构成了严重威胁。它能感染多种重要作物,如苜蓿[1]、烟草[2]、红薯、花生、西葫芦[3]以及花椒[4]等,通过分泌毒素和降解酶侵害作物的维管束系统,引发一系列如枯萎和腐烂的症状,最终导致作物死亡,严重影响作物产量和农业发展,因此防治镰刀菌在农业生产中尤为重要。
在众多生物防治策略中,芽孢杆菌属(Bacillus)微生物因其出色的防治效果和环境适应性而被广泛研究[5]。特别是解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)和蜡状芽孢杆菌(Bacillus cereus),它们能有效控制植物病害[6]。其中,解淀粉芽孢杆菌因其卓越的次生代谢产物产生能力,成为一种重要的生防微生物[7]。除了具有显著的病害防治效果,它还能促进植物生长,改善根际土壤微生物种群结构,对延长果蔬保鲜期也有积极作用[8]。
解淀粉芽孢杆菌发酵产物能产生抑菌物质,其发酵产物提取物对病原菌的抑制作用通常表现在对病原菌菌丝和形态的影响,如解淀粉芽孢杆菌(B.amyloliquefaciens)SWB16[9]、B. amyloliquefaciens BI2[10]、B. amyloliquefaciens QHL-52[11]分别对球孢白僵菌(Beauveria bassiana)、黄曲霉(Aspergillus flavus)、番茄灰霉病菌(Botrytis cinerea)孢子萌发及生长具有明显的抑制及破坏作用。KIM Y G等[12]分离得到一株产多肽的解淀粉芽孢杆菌PT14-4a,其对茄腐镰刀菌有明显的抑制作用;此外,解淀粉芽孢杆菌GB03可促进木薯地上部和根系生长[13]。这些研究表明,解淀粉芽孢杆菌对多种病原菌具有巨大的生防潜力,是一个潜在的优质生防库。
本实验以一株拮抗茄腐镰刀菌菌株M1为研究对象,通过形态学观察、生理生化试验和分子生物学技术对菌株M1进行鉴定。采用平板对峙法评估菌株M1的广谱抗菌效果,利用不同有机溶剂萃取菌株M1发酵产物,通过测定菌丝生长和孢子萌发等方式探究菌株M1对茄腐镰刀菌的抑菌机制,并通过盆栽实验验证其对小麦促生效果。旨在探究菌株M1抑菌谱及其代谢产物对茄腐镰刀菌的抑菌机理,同时探究其对小麦促生指标,为进一步挖掘细菌次级代谢产物的结构和深入开发利用微生物资源奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌株M1、靶标病原菌[茄腐镰刀菌(Fusarium solani)、黑根霉(Rhizopus stolonifer)、链格孢霉(Alternaria alternata)、尖孢镰刀菌(Fusarium oxysporum)、齐整小核菌(Sclerotium rolfsii)]:河南工业大学工业微生物菌种保藏与选育河南省工程实验室分离、保存。
1.1.2 化学试剂
酵母浸粉、胰蛋白胨、蛋白胨、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;葡萄糖、氯化钠、羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na)、硫酸镁、磷酸二氢钾(均为分析纯):天津市科密欧化学试剂有限公司;过氧化氢酶(catalase,CAT)活性检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、过氧化物酶(catalase,POD)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:PDA培养基中不添加琼脂。
LB液体培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
羧甲基纤维素钠(CMC-Na)培养基:蛋白胨1 g,羧甲基纤维素钠1 g,酵母膏0.5 g,NaCl 1 g,MgSO4·7H2O 0.02 g,KH2PO4 0.1 g,琼脂20 g,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
QYC-200恒温培养摇床:上海新苗医疗器械制造有限公司;5810R型离心机:德国Eppendorf公司;XY-SH培养箱:上海昕仪仪器仪表有限公司;Axio Observer 3倒置荧光显微镜:德国蔡司公司;UV-3100PC型紫外分光光度计:上海美谱达仪器有限公司;PHS-3C pH计:上海雷磁仪器有限公司;A200型聚合酶链式反应(polymerase chain reaction,PCR)仪:杭州朗基科学仪器有限公司;DYY-6C型电泳仪:北京六一生物科技有限公司;MiniGel S1型凝胶成像系统:北京森西赛智科技有限公司;R-1001VN型旋转蒸发仪:郑州长城科工贸有限公司。
1.3 方法
1.3.1 菌株鉴定
(1)形态特征观察
在LB固体培养基上划线接种甘油保藏的菌株M1,37 ℃培养48 h,观察菌落形状、颜色、光泽和边缘特征等情况。利用革兰氏染色后,在显微镜下观察菌株M1细胞形态。
(2)生理生化特征
综合《常见细菌系统鉴定手册》[14]和《伯杰鉴定手册》[15]所述方法对菌株M1 进行生理生化试验。
(3)分子生物学鉴定
16S rDNA扩增所使用的引物对为正向引物F(5'-AGAGTTTGATCCTGGCTCAG-3')和反向引物R(5'-CTACGGCTACCTTGTTACGA-3')。PCR扩增体系(50.0 μL)为:上、下游引物各1.5 μL,细菌基因组1.0 μL,10×Buffer 5.0 μL,Taq聚合酶1.0 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1.0 μL,双蒸水(ddH2O)39.0 μL。PCR扩增条件为:95 ℃、5 min;95 ℃、30 s,58 ℃、30 s,72 ℃、90 s,35个循环;72 ℃、7 min。PCR产物送至武汉擎科生物有限公司完成测序,将得到的序列在美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)GenBank数据库中进行基于局部比对搜索工具(basic local alignment search tool,BLAST)比对查找相似序列,选择相似性>99%的序列下载,用MEGA7.0软件中的邻接(neighborjoining,N-J)法构建系统发育树[16]。
1.3.2 菌株M1的广谱抗菌效果测定
采用平板对峙法[17]测定抑菌M1广谱抗菌效果,待对照病原菌长至平板3/2面积时,计算抑制率,其计算公式如下:
式中:测量对照组病原菌菌落半径(R0),cm;处理组病原菌抑制区半径(R1),cm。
1.3.3 菌株M1发酵液及发酵产物正丁醇提取物的制备
菌株M1发酵液的制备:将菌株M1接种于PDB中,37 ℃、200 r/min 摇床培养12 h活化后,再以2%的接种量接种到2 L新鲜的马铃薯葡萄糖肉汤培养基中,于37 ℃、200 r/min 摇床培养48 h,即得到菌株M1发酵液。
菌株M1发酵产物正丁醇提取物的制备:将上述发酵液经4 ℃、8 000 r/min 离心10 min后除去菌体,用0.45 μm水相滤膜过滤,得发酵上清液。用5 mol/L盐酸溶液将其pH调至2.0,4 ℃静置过夜后4 ℃、9 000 r/min离心10 min 收集沉淀,选用有机溶剂正丁醇400 mL对沉淀进行抽提萃取,超声波辅助溶解,4 ℃、120 000 r/min离心10 min取上清,经旋转蒸发仪75 ℃、55 r/min蒸干,再用20 mL甲醇溶解得到正丁醇提取物[18]。
1.3.4 菌株M1对病原菌的抑菌机理
(1)菌株M1发酵产物正丁醇提取物对病原菌菌丝生长的影响
在100 mL PDA培养基冷却至40~50 ℃时,向其中加入2 mL的正丁醇提取物,并倾倒平板,以未添加任何物质的PDA培养基为对照组。在PDA平板中央接种0.5 mm茄腐镰刀菌菌饼。探究菌株M1发酵产物正丁醇提取物对茄腐镰刀菌菌丝生长的抑制效果。通过菌丝生长抑制法[19],测定菌株M1发酵产物正丁醇提取物对茄腐镰刀菌菌丝生长的影响,每项处理均进行3次重复。菌丝生长抑制率计算公式如下:
式中:A是未经处理的茄腐镰刀菌的直径,cm;a是加入正丁醇提取物的茄腐镰刀菌的直径,cm;0.5是接种茄腐镰刀菌的直径,cm。
(2)菌株M1发酵产物正丁醇提取物对病原菌孢子萌发的影响
采用孙云祥等[20]的方法制备茄腐镰刀菌孢子悬液1×105 CFU/mL封存于30%的甘油管中,于-80 ℃保存备用。
精确吸取0.50 mL孢子悬液与同体积正丁醇提取物混合于2 mL离心管中,30 ℃、200 r/min摇床培养12 h、18 h、24 h、30 h、36 h,检测孢子萌发数,以无菌水为对照,每个处理组设置3个重复[10]。孢子萌发率及抑制率计算公式如下[21]:

(3)菌株M1发酵产物正丁醇提取物对病原菌菌丝细胞膜,活性氧积累的影响
取茄腐镰刀菌新鲜菌丝悬液200 μL置于1.5 mL离心管中,加800 μL PDB培养基,30 ℃培养12 h后,收集菌丝,加入无菌生理盐水洗涤菌丝3次。在菌丝中加入200 μL菌株M1发酵产物正丁醇提取物,以不加入任何物质为对照,随后用磷酸盐缓冲液(phosphate buffer solution,PBS)补充至1 mL,于30 ℃、150 r/min条件下振荡处理12 h,用无菌生理盐水洗涤并收集菌丝。分别加入1 mL 10 μmol/mL的2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)溶液和10 μL 1 mg/mL的碘化丙锭(propidium iodide,PI)溶液,30 ℃培养箱避光孵育20 min,染色后用无菌生理盐水洗涤3遍后收集菌丝,制片,荧光显微镜在488 nm和535 nm激发波长下观察菌丝形态并拍照。考察菌株M1发酵产物正丁醇提取物对病原菌菌丝细胞膜,活性氧积累的影响[20]。
1.3.5 菌株M1发酵产物正丁醇提取物对病原菌菌丝抗氧
化能力的测定
挑取5个茄腐镰刀菌菌饼于100mLPDB培养基中,30℃、200 r/min培养48 h后,将新鲜的茄腐镰刀菌菌丝球吸出,每100 mL 5个菌丝球,并分别加入1 mL和2 mL菌株M1发酵产物正丁醇提取物使其终浓度为1%和2%,以不添加任何物质为对照组,每个实验组均进行3次重复,于30 ℃、200 r/min孵育24 h,孵育结束后,收集菌丝沉积物。超氧化物歧化酶(SOD)、过氧化物酶(POD)酶活、过氧化氢酶(CAT)酶活以及丙二醛(MDA)含量按照康KANG K等[22]描述的方法进行测定。
1.3.6 菌株M1对小麦的促生作用
(1)栽培方法
小麦种子催芽后,参照章梦婷等[23]无菌蛭石系统进行培养。将80 g蛭石装入1 L大烧杯中,厚度约3~5 cm。用牛皮纸包好后于121 ℃灭菌30 min,待完全冷却至室温后将萌发的小麦种子播种其中。注意胚根朝下,种子上面再覆盖浅层无菌蛭石。每个烧杯里种5棵苗,浇透水后放在通风光照处培养,保持水分管理。
(2)菌株M1菌悬液处理小麦根围
菌株M1处理小麦根围:将菌株M1以2%接种量接于100 mL LB培养基中,于37 ℃、200 r/min培养过夜,离心去上清,用无菌水重悬菌体再离心,重复以上操作两次,最后将菌体悬浮在等量无菌水中,即得菌株M1菌悬液。1周后,待小麦形成初步的根系后,将菌株M1菌悬液作为处理组施用到小麦幼苗根部附近,每棵幼苗10 mL菌株M1菌悬液,以施用等量无菌水作为对照组。每隔3 d处理1次,共处理3次,处理组和对照组各设置5个重复。完成3次促生处理,1周后开始取样,每隔7 d取样,共3次。
(3)小麦生物量测定
将小麦苗连带蛭石轻轻取出后,用平缓的水流冲洗幼苗根部蛭石,小心地分开根系,用纸巾吸干根部水分后,测量小麦生物量,包括株高、株鲜质量、根长、根鲜质量。
1.3.7 数据处理
本研究中,所有数据的统计与分析工作均通过Microsoft Excel 2021软件完成,利用GraphPad Prism 8.0软件进行数据的可视化处理,采用了SPSS 26.0软件进行了单因素方差分析。在差异显著性分析方面,采用Duncan's法,以P<0.05为差异显著。
2 结果与分析
2.1 菌株M1的鉴定
2.1.1 形态学观察
菌株M1的菌落和细胞形态观察结果见图1。由图1 A可知,菌株M1单菌落呈扁平或圆形,乳白色,不透明,表明半干燥,有隆起褶皱。由图1 B可知,显微镜下菌体呈杆状,产芽孢,革兰氏染色结果呈阳性。
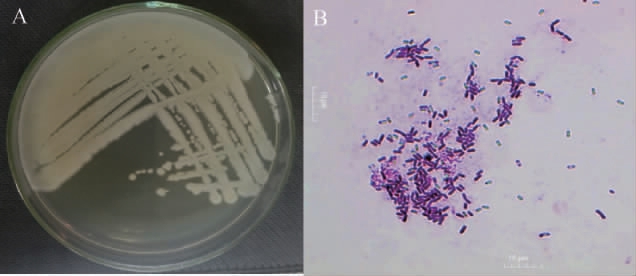
图1 菌株M1的菌落形态(A)及细胞形态(B)
Fig.1 Colony (A) and cell (B) morphology of strain M1
2.1.2 菌株M1生理生化鉴定结果
菌株M1甲基红反应阳性,硝酸盐还原反应阳性,可利用蔗糖、葡萄糖、果糖和麦芽糖,能水解淀粉、脲酶,且这些生理生化特征与已报道的解淀粉芽孢杆菌生理生化特征一致[24]。结合形态学观察及生理生化试验结果将M1初步鉴定为芽孢杆菌属(Bacillus)。
表1 菌株M1的生理生化试验结果
Table 1 Physiological and biochemical experiments results of strain M1

注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目 结果 项目 结果柠檬酸盐淀粉水解接触酶硝酸盐还原葡萄糖利用+++++甲基红脲酶水解蔗糖发酵果糖利用麦芽糖利用+++++
2.2 分子生物学鉴定
以菌株M1基因组DNA为模板扩增其16S rDNA序列,将16S rDNA序列与GenBank数据库中的核苷酸序列进行同源性分析,结果显示菌株M1与解淀粉芽孢杆菌16S rDNA序列的同源相似性最高,为99%。由图2可知,菌株M1与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)位于同一分支,结合菌体形态特征及生理生化鉴定结果,菌株M1被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),将其核酸序列上传至GenBank,获取登录号为:ON038714。
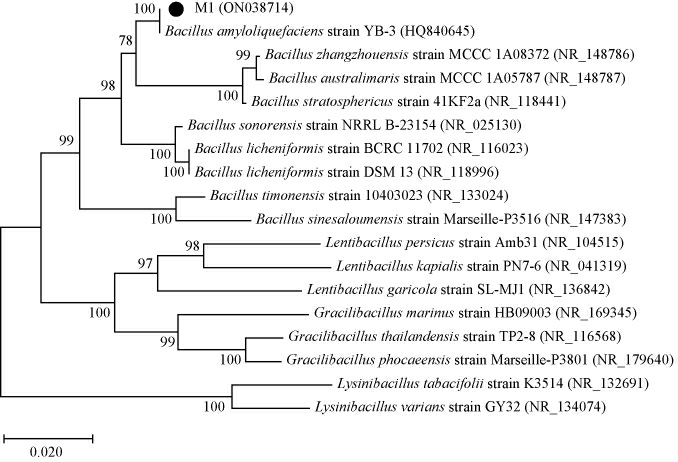
图2 菌株M1基于16S rDNA基因序列的系统发育进化树
Fig.2 Phylogenetic evolutionary tree of strain M1 based on 16S rDNA gene sequence
2.3 菌株M1抑菌谱
以病原菌自然生长为对照,采用平板对峙法[17]测定抑菌M1广谱抗菌效果,并计算抑制率,结果见图3。
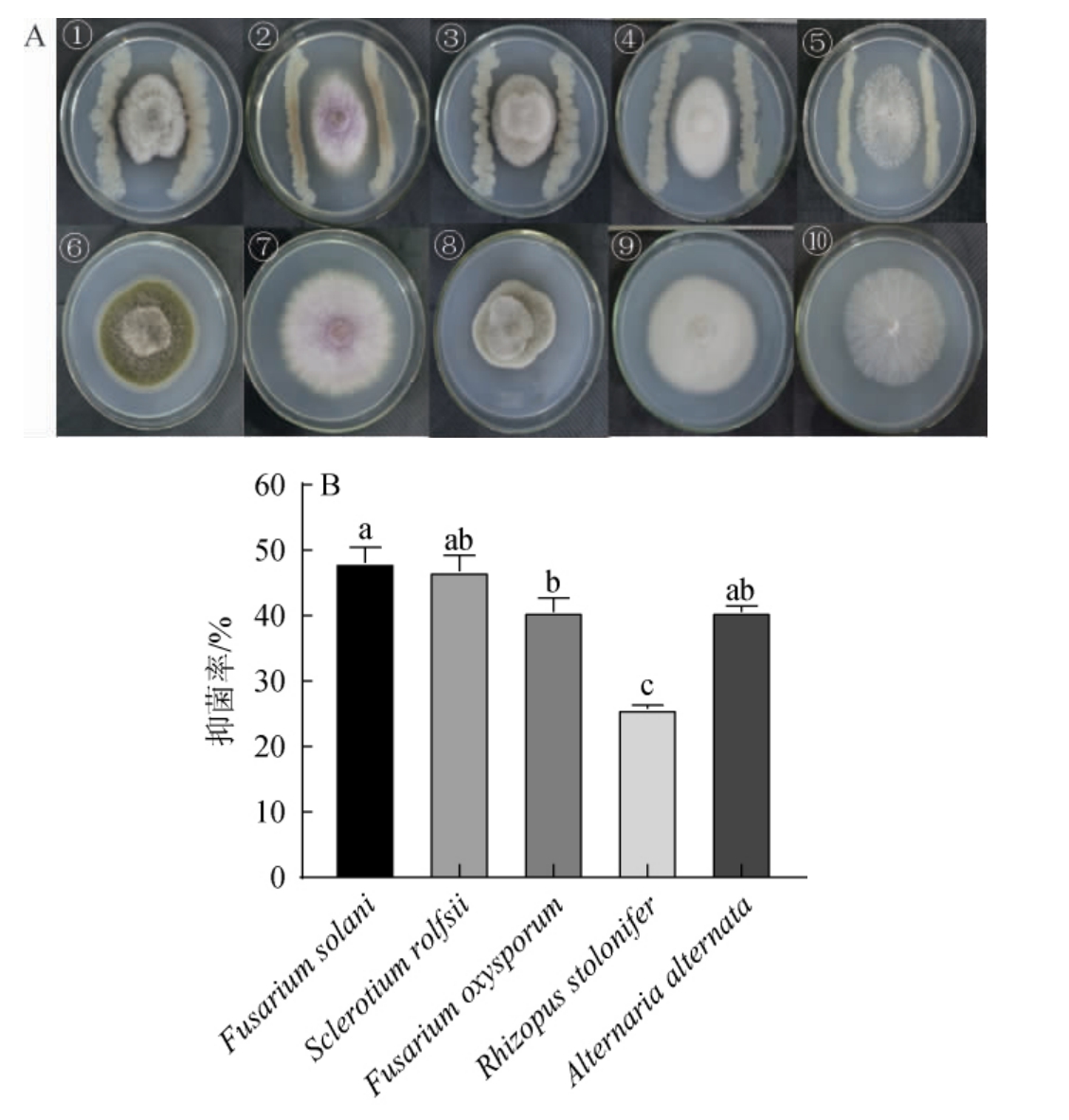
图3 菌株M1对5种真菌生长的影响(A)及抑菌作用(B)
Fig.3 Effects of strain M1 on the growth of 5 kinds of fungi (A) and antibacterial effect (B)
①:链格孢霉(Alternaria alternata);②:尖孢镰刀菌(Fusarium oxysporum);③:黑根霉(Rhizopus stolonifer);④:茄腐镰刀菌(Fusarium solani);⑤:齐
整小核菌(Sclerotium rolfsii);⑥~⑩:CK;不同小写字母表示差异显著(P<0.05)。
由图3可知,菌株M1对5种供试真菌均有不同程度的抑制作用,其中对茄腐镰刀菌抑制作用最强,抑菌率为48.08%,其次对齐整小核菌、链格孢霉、尖孢镰刀菌也有较强的拮抗作用,抑菌率分别为46.77%、41.65%、40.57%,对根霉的抑制作用最小,仅25.73%。结果表明,菌株M1对多种植物病原菌均有较好的抑制作用,这与其他研究结果一致[10,25]。
2.4 菌株M1对病原菌的抑菌机理
2.4.1 菌株M1发酵产物正丁醇提取物对病原菌菌丝生长的影响
由图4可知,培养2 d时,对照组茄腐镰刀菌菌落直径为3.21 cm,加入正丁醇提取物处理的菌落直径为1.32 cm,小于对照组,说明处理组菌丝生长初期受限,但并未完全失去生长能力;随着菌丝生长,培养6 d后,正丁醇提取物处理组抑菌率达到76.92%。结果表明,随着时间的推移,菌丝的生长显著受到了抑制,正丁醇提取物的抑制效果明显且抑菌效果明显优于原菌,因此在后续实验中采用正丁醇提取物进行进一步研究。
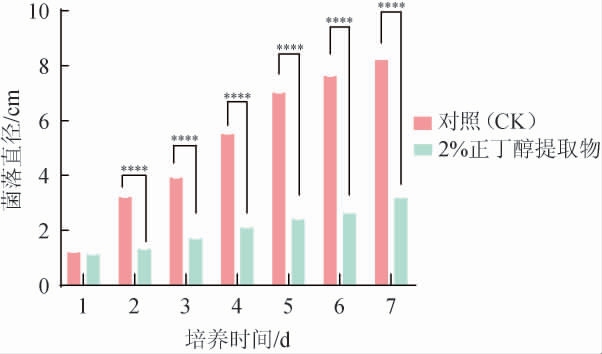
图4 菌株M1发酵产物正丁醇提取物对病原菌菌丝生长的影响
Fig.4 Effect of n-butanol extract from strain M1 fermentation product on mycelial growth of pathogenic bacteria
“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);“***”表示差异非常显著(P<0.001);“****”表示差异高度显著
(P<0.000 1)。下同。
2.4.2 菌株M1发酵产物正丁醇提取物对病原菌孢子萌发的影响
菌株M1发酵产物正丁醇提取物对病原菌孢子萌发的影响结果见表2。由表2可知,菌株发酵产物M1正丁醇提取物可明显抑制孢子的萌发,在病原菌生长36 h时,对照组孢子完全萌发时,处理组孢子萌发率仅为21%。说明菌株M1发酵产物正丁醇提取物对病原菌孢子萌发有明显抑制作用,结果表明,菌株M1产生的次级代谢物对茄腐镰刀菌有拮抗作用。
表2 菌株M1发酵产物正丁醇提取物对茄腐镰刀菌孢子萌发的影响
Table 2 Effect of n-butanol extract from strain M1 fermentation product on spore germination of Fusarium solani

项目对照组处理组孢子萌发率/%12 h 18 h 24 h 30 h 36 h 16.33±1.53e 2.33±0.33d 54.00±1.15d 4.00±0.58d 71.00±0.58c 14.00±0.58c 81.67±0.88b 16.67±0.88b 98.67±7.50a 21.00±0.58a
2.4.3 菌株M1发酵产物正丁醇提取物对茄腐镰刀菌细胞膜的影响
菌株M1发酵产物正丁醇提取物对茄腐镰刀菌细胞膜的影响见图5。由图5可知,在荧光显微镜下,观察到菌株M1发酵产物正丁醇提取物处理的茄腐镰刀菌菌丝体表面变得更粗糙,许多菌丝体显示出异常的扭曲状态和更多的分支节点,而未处理的茄腐镰刀菌菌丝体的形态更均匀,没有显示出上述形态。由图5 a可知,经碘化丙锭(PI)染色后,可以观察到经菌株发酵产物M1正丁醇提取物处理的菌丝体发出明显的红色荧光,而未处理的菌丝体未显示荧光,表明菌株M1发酵产物正丁醇提取物显著破坏了菌丝体的细胞膜完整性。由图5 b可知,经DCFH-DA染色后,在显微镜下观察到明显的蓝色荧光,可以看出处理后导致茄腐镰刀菌丝体中活性氧(reactive oxygen species,ROS)的大量积累,表明提取物可能会引起细胞氧化应激甚至凋亡。许多抗菌物质作用的靶标为病原菌的细胞膜,其主要作用机制通过破坏细胞膜结构导致病原菌死亡[26]。
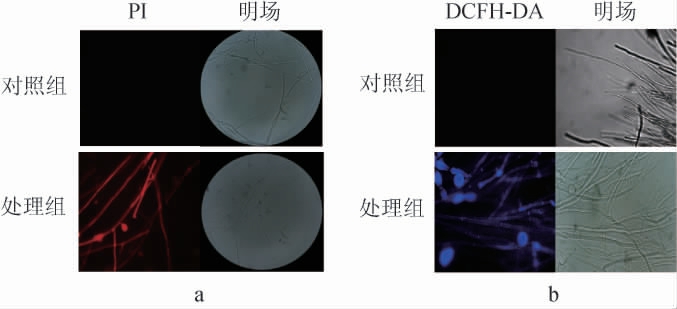
图5 菌株M1发酵产物正丁醇提取物对茄腐镰刀菌细胞膜的影响
Fig.5 Effect of n-butanol extract from strain M1 fermentation product on cell membrane of Fusarium solani
a:PI染色;b:DCFH-DA染色。
2.5 菌株M1发酵产物正丁醇提取物对茄腐镰刀菌抗氧化活性影响
菌株M1发酵产物正丁醇提取物对茄腐镰刀菌抗氧化活性影响结果见图6。由图6可知,随着正丁醇提取物添加量的增加,SOD、POD、CAT三种抗氧化酶活性明显降低。这与KANG K等[22]的报道用拮抗菌发酵产物提取物处理病原菌时,三种酶酶活升高结果一致。由图6A可知,正丁醇提取物处理后的菌丝SOD酶活较对照整体呈下降趋势,其活性的降低可能意味着细胞内超氧自由基的减少。SOD的主要功能是催化超氧化物的歧化反应,从而清除细胞内的超氧自由基,这可能是由于正丁醇提取物减少了细胞内的氧化应激。由图6B可知,正丁醇提取物处理后菌丝的POD酶活与对照相比呈现显著下降,其活性的降低可能意味着细胞的抗氧化防御能力受到削弱。POD是一种重要的抗氧化酶,它帮助细胞清除过氧化氢和其他有害的氧自由基,从而保护细胞免受氧化损伤。由图6C可知,经过正丁醇提取物处理后菌丝的CAT酶活出现明显的降低趋势,CAT活性的降低可能意味着细胞内过氧化氢的减少,这可能是由于抑菌物质减少了细胞内的氧化应激。由图6D可知,丙二醛(MDA)含量明显升高,表明病原菌细胞膜遭到破坏。MDA是膜脂过氧化最重要的产物之一,它的产生会加剧膜的损伤,通过检测其含量了解膜脂过氧化的程度,进而评估膜系统受损程度[27]。这与毕钰等[28]报道中生物体在受到胁迫时MDA水平上升的结论相符。表明经过菌株M1的发酵产物正丁醇提取物处理后,菌丝体内的氧化应激显著增加,同时脂质过氧化现象也明显加剧。这种氧化应激和脂质过氧化的增强,不仅改变了细胞膜的结构和功能,还影响了细胞膜的流动性和通透性,破坏了细胞内环境的稳定,对菌丝的生长产生了显著的抑制效应。
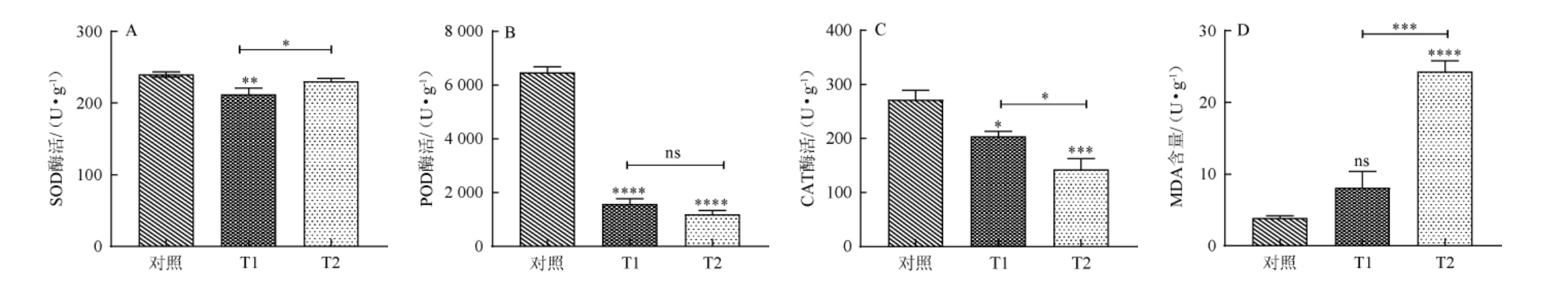
图6 菌株M1发酵产物正丁醇提取物对茄腐镰刀菌菌丝体抗氧化活性的影响
Fig.6 Effect of n-butanol extract from strain M1 fermentation product on antioxidant activities of Fusarium solani
2.6 菌株M1菌悬液处理蛭石基质栽培小麦
菌株M1菌悬液处理对蛭石基质栽培系统中的小麦幼苗生物量的影响结果见图7。由图7可知,在蛭石栽培条件下,菌株M1对小麦幼苗展现出显著的促生效应。自促生处理第1周起,施用M1菌悬液显著提升了小麦幼苗的根长、株高及整体鲜质量。并且在接下来的两周里,这种差异持续显著。在生长的第15天,M1处理组的小麦幼苗株高、根长、植株鲜质量和根部鲜质量较对照组分别增加了15.98%、8.60%、42.46%和33.33%。至第30天,M1处理组的小麦幼苗株高、根长、植株鲜质量和根部鲜质量较对照组的增幅进一步上升至20.72%、21.50%、61.72%和32.29%。综上所述,施用菌株M1菌悬液不仅显著促进了小麦幼苗的生长,也显著增加了其生物量。这与庞亚琴等[29]所述不同施加量的解淀粉芽孢杆菌HM618发酵液对小麦幼苗均有一定的促生作用的结果相一致。

图7 菌株M1菌悬液处理对蛭石基质栽培系统中的小麦幼苗生物量的影响
Fig.7 Effect of strain M1 suspension treatment on wheat seedling biomass in vermiculite culture system
A、B所示分别为第15天和第30天时空白组与M1 处理组间的小麦苗的株高、根长、株鲜质量和根鲜质量的差异显著性分析;C、D、E、F分别展示第15天和第30天时空白组与M1处理组的小麦整株差异。
3 结论
本研究筛选出一株拮抗茄腐镰刀菌效果最好的菌株M1,经鉴定其为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),发现菌株M1具有较广的抑菌谱,从菌株M1中提取的正丁醇提取物能够抑制病原菌F.solani菌丝生长,且有效抑制F.solani孢子萌发,对菌丝,孢子抑制率分别达到了76.92%和77.67%;菌株M1能显著破坏茄腐镰刀菌的细胞膜,造成细胞内活性氧积累;导致SOD,POD,CAT酶活显著下降,MDA含量显著上升,表明菌丝体内氧化应激显著增加,同时脂质过氧化现象也明显加剧。这不仅改变了细胞膜的结构和功能,还影响了细胞膜的流动性和通透性,破坏了细胞内环境的稳定,对菌丝的生长产生了显著的抑制效应。菌株M1菌悬液表现出对小麦具有良好的促生特性。30 d时,菌株M1处理组的小麦幼苗株高、根长、植株鲜质量和根部鲜质量提高率较对照组达到20.72%、21.50%、61.72%和32.29%。因此,菌株M1有望在多种植物病害中发挥重要作用,并具备未来发展应用的潜力,未来的研究将重点关注该菌株在田间应用及生物防御机制的进一步探索。
[1]陈博,牛艺帆,刘晓宇,等.腐皮镰刀菌病原致病性及苜蓿品种抗病性研究[J].草业学报,2023,32(10):115-128.
[2]YANG M,CAO J D,ZHENG Y X,et al.First report of fusarium root rot of tobacco caused by Fusarium solani in Lincang,China[J].Plant Disease,2020,104(5):1541.
[3]PÉREZ-HERNÁNDEZ A,ROCHA L O,PORCEL-RODRÍGUEZ E,et al.Pathogenic,morphological,and phylogenetic characterization of Fusarium solani f.sp. cucurbitae isolates from cucurbits in Almería province, Spain[J].Plant Disease,2020,104(5):1465-1476.
[4]阮钊,丁俊园,唐光辉,等.花椒根腐病的病原鉴定与防治药剂筛选[J].植物病理学报,2022,52(4):630-637.
[5]TAN S Y,JIANG Y,SONG S,et al.Two Bacillus amyloliquefaciens strains isolated using the competitive tomato root enrichment method and their effects on suppressing Ralstonia solanacearum and promoting tomato plant growth[J].Crop Protection,2013,43:134-140.
[6]FRANCIS I, HOLSTERS M, VEREECKE D.The gram-positive side of plant-microbe interactions[J].Environ Microbiol,2010,12(1):1-12.
[7]PÉREZ-GARCÍA A,ROMERO D,DE VICENTE A.Plant protection and growth stimulation by microorganisms: biotechnological applications of Bacilli in agriculture[J].Curr Opin Biotech,2011,22(2):187-193.
[9]汪静杰,赵东洋,刘永贵,等.解淀粉芽孢杆菌SWB16菌株脂肽类代谢产物对球孢白僵菌的拮抗作用[J].微生物学报,2014,54(7):778-785.
[10]王德培,孟慧,管叙龙,等.解淀粉芽孢杆菌BI_2的鉴定及其对黄曲霉的抑制作用[J].天津科技大学学报,2010,25(6):5-9.
[11]李红晓.解淀粉芽孢杆菌抑菌作用机理的探究[D].沈阳:沈阳师范大学,2016.
[12]KIM Y G, KANG H K, KWON K-D, et al.Antagonistic activities of novel peptides from Bacillus amyloliquefaciens PT14 against Fusarium solani and Fusarium oxysporum[J].J Agr Food Chem,2015, 63(48):10380-10387.
[13]FREITAS M A,MEDEIROS F H V,MELO I S,et al.Stem inoculation with bacterial strains Bacillus amyloliquefaciens(GB03)and Microbacterium imperiale (MAIIF2a) mitigates Fusarium root rot in cassava[J].Phytoparasitica,2019,47(1):135-142.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:370-389.
[15]布坎南RE,吉本斯NE.伯杰鉴定手册[M].第8版.北京:科学出版社,1995:591-611.
[16]胡娴,陈宸彤,谢杨鋆,等.钩状木霉菌的生物学特性及对腐皮镰刀菌的抑菌机理研究[J].中国生物防治学报,2022,38(1):81-87.
[17]李爽,张志钒,高飞,等.花生白绢病菌拮抗细菌的分离鉴定及其温室抑菌促生效果[J].农药学学报,2024,26(2):1-16.
[18]刘安,赵华,张朝正.贝莱斯芽孢杆菌抑菌物质的分析及提取优化[J].中国酿造,2019,38(12):63-68.
[19]敖静,李杨,刘晓辉,等.一株黄瓜枯萎病拮抗细菌的筛选鉴定及抑菌作用初探[J].云南农业大学学报(自然科学),2022,37(3):429-434.
[20]孙云祥.脂肽Surfactin诱导禾谷镰刀菌细胞凋亡研究[D].郑州:河南工业大学,2023.
[21]出晓铭.生防菌解淀粉芽孢杆菌LY-1抗菌脂肽IturinA的纯化鉴定及抑菌机理研究[D].福州:福建农林大学,2016.
[22]KANG K,NIU Z P,ZHANG W,et al.Antagonistic strain Bacillus halotolerans Jk-25 mediates the biocontrol of wheat common root rot caused by Bipolaris sorokiniana[J].Plants,2023,12(4):828.
[23]章梦婷,王二兴,张雅婷,等.黄瓜根际促生菌Bacillus subtilis S1的分离鉴定与促生抗病[J].微生物学通报,2024,51(6):2141-2157.
[24]姚博,何依璐,张晋豪,等.解淀粉芽孢杆菌JK10的鉴定及其对蓝莓根癌病的防治效果[J].江西农业大学学报,2022,44(4):891-899.
[25]陈照,李培征,刘惠芳,等.解淀粉芽孢杆菌HAB-9的鉴定及对17株植物病原菌的拮抗作用[J].热带农业科学,2019,39(7):47-52.
[26]LI L R,SHI Y H,CHENG X R,et al.A cell-penetrating peptide analogue,P7, exerts antimicrobial activity against Escherichia coli ATCC25922 via penetrating cell membrane and targeting intracellular DNA[J].Food Chem,2015,166:231-239.
[27]张树生,胡蕾,刘忠良,等.植物体内抗病相关酶与植物抗病性的关系[J].安徽农学通报,2006(13):48-49,5.
[28]毕钰,张琳,余红凤,等.小麦赤霉病拮抗菌JB7的拮抗活性及鉴定[J].微生物学报,2024,64(5):1580-1592.
[29]庞亚琴,任彩婷,徐秋曼.解淀粉芽孢杆菌HM618对镉胁迫下小麦幼苗生长的影响[J].天津师范大学学报(自然科学版),2018,38(4):55-59.