乙酸乙酯是一种挥发性短链脂肪酸,是许多食品和发酵食品(如酱料、奶酪、白酒、啤酒和葡萄酒等)的重要香气成分,尽管其在各种蔬菜、水果和浆果中天然存在,但含量较低,提取成本较高[1]。研究表明,乙酸乙酯在各香型白酒中含量较高,是白酒四大骨架酯之一,同时也是清香型白酒的主体香气组分之一[2]。除了在食品领域作为食用香料和调味品用于提升风味,乙酸乙酯还在化妆品和香精中广泛应用[3]。此外,乙酸乙酯是一种关键的工业化合物,被作为化学溶剂广泛应用于柴油、涂料、油漆、粘合剂、增塑剂和聚合物添加剂等领域[4],市场需求量大。
目前,乙酸乙酯大规模的生产主要以乙酸和乙醇为原料,浓硫酸为催化剂,在高温高压下酯化合成。该工艺技术成熟、产率高,但存在副反应多、易损坏设备、“三废”排放量大等弊端[5]。此外,通过固定化脂肪酶催化乙酸和乙醇合成乙酸乙酯可以在常温常压进行,副产物低,但合成收率低、成本较高,限制了其大规模生产应用[5-6]。因此,有必要开发更加高效和环保的新型生产工艺或代谢途径。近年来,利用生物发酵法合成短链挥发性酯类在国内外已引起广泛关注[7-8]。生物发酵法合成酯的原料可持续再生,过程绿色环保,且反应条件温和、产品纯度高,深受消费者的青睐[8-9]。在生物发酵过程中,细菌、霉菌、酵母等均能利用糖类合成酯类化合物,而酵母菌更偏好产生乙酸乙酯,如,马克斯克鲁维酵母(Kluyveromyces marxianus)利用乳糖产生的主要酯类物质为乙酸乙酯[10];百利酵母(Zygosaccharomyces bailii)能够利用葡萄糖和果糖产生乙酸乙酯[11];异常毕赤酵母(Pichia anomala)利用葡萄糖发酵得到乙酸乙酯的产量为2.86 g/L[12];陈雪等[13]从酒醅中筛选得到一株异常毕赤酵母(P.anomala)MY0-3,其在高粱汁中发酵后乙酸乙酯产量为3.73 g/L;李泽洋等[14]分离到一株费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii),其在液化和糖化后的籼米粉培养基中培养7 d后乙酸乙酯产量为2.88 g/L;贾丽艳等[15]分离到一株酿酒酵母(Saccharomyces cerevisiae),其在糖浆发酵液中培养7 d后乙酸乙酯产量为0.65 g/L;李景辉等[16]筛选到一株东方伊萨酵母菌(Issatchenkia orientalis)GTY-837,并将其应用于酱香型白酒堆积发酵,酒醅堆积发酵48 h后的乙酸乙酯产量为1.08 g/L;许银等[17]从浓香型大曲中分离到一株异常威克汉姆酵母(Wickerhamomyres anomalus)Y87,其在高粱汁和高粱中发酵后,乙酸乙酯产量分别达到1.13 g/L和1.14 g/L。此外,有研究表明酵母菌的共培养能够促进乙酸乙酯的产生,如汪晗等[18]将酿酒酵母(Saccharomyces cerevisiae)与异常威克汉姆酵母(Wickerhamomyces anomalus)LL-7、粟酒裂殖酵母(Schizosaccharomyces pombe)SCC-7进行1∶1∶1混合培养,乙酸乙酯含量比单独培养的异常威克汉姆酵母提升了29.36%;FAN G S等[19]研究发现,异常威克汉姆酵母(W.anomalus)与酿酒酵母(S.cerevisiae)按3∶1共培养时,乙酸乙酯产量高达6.41 g/L。以上研究报道为乙酸乙酯的生物合成与绿色生产提供了新思路,但目前分离得到的菌株普遍存在产酯不稳定、产量不高的问题,无法满足市场对乙酸乙酯产量的需求。因此,从自然界中筛选稳定高产的功能菌,并对其产酯特性及产酯条件进行探索及优化,对于乙酸乙酯工业化生产有重要价值和意义。
本研究采用传统培养分离方法及乙酸乙酯产量测定从浓香型白酒酒醅中分离筛选高产乙酸乙酯的酵母菌,通过形态学观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并以乙酸乙酯产量为响应值,通过单因素试验、Plackett-Burman试验和响应面对其发酵工艺进行优化,以期为乙酸乙酯的生物发酵及功能菌开发利用提供理论与数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂浓香型白酒酒醅样品:从不同的白酒生产企业采集;蛋白胨、牛肉浸粉、琼脂、酵母粉(均为生化试剂):北京奥博星生物技术有限责任公司;可溶性淀粉(生化试剂):生物生工工程(上海)股份有限公司;甲醇(色谱纯):美国Sigma-Aldrich公司;M5超光速mix(MF848)试剂盒:北京聚合美生物科技有限公司。其他试剂均为国产分析纯。
1.1.2 培养基
孟加拉红培养基[14]:5.0 g/L蛋白胨,1.0 g/L KH2PO4,0.5 g/L MgSO4,10.0 g/L葡萄糖,0.1 g/L氯霉素,0.033 g/L孟加拉红,20.0 g/L琼脂,pH自然。
酵母浸出粉胨(yeast extract peptone dextrose,YPD)培养基[14]:10.0 g/L酵母膏,20.0 g/L蛋白胨,20.0 g/L葡萄糖,pH自然。YPD固体培养基:YPD培养基中加入20.0 g/L琼脂。
发酵培养基[20]:10.0 g/L酵母粉,20.0 g/L蛋白胨,80.0 g/L葡萄糖,pH 6.5。
以上培养基均在115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
JA1203N电子天平:上海恒平科学仪器有限公司;TU-108紫外分光光度计:北京普析通用仪器有限公司;DY-8C旋涡振荡仪:苏州净化设备有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;5424台式小型离心机:德国Eppendrof公司;LDX-75KB电热恒温培养箱:北京市六一仪器厂;AIRTECH超洁净工作台:苏州安泰空气技术有限公司;2010PLUSAF气相色谱(gas chromatography,GC)仪:日本岛津公司;Mastercyler Pro聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendrof公司;Tanon1600凝胶成像仪:美国伯乐公司。
1.3 试验方法
1.3.1 高产乙酸乙酯酵母菌的分离及筛选
将10 g酒醅样品加入90 mL无菌水中振荡富集24 h。将富集液梯度稀释至10-6,取每个梯度悬液100 μL涂抹于孟加拉红培养基平板上,在30 ℃条件下孵化3~5 d。从平板中选择具有不同形态的单菌落接种到YPD培养基,28 ℃、180 r/min条件培养24 h后,按3%(V/V)的接种量接种到30 mL发酵培养基中,在28 ℃、180 r/min条件下培养48 h,培养液在12 000×g的条件下离心2 min,过滤上清液,采用GC法测定乙酸乙酯含量[21]。
1.3.2 高产乙酸乙酯酵母菌鉴定
形态学观察和生理生化试验:根据FAN G S等[22]的方法对高产乙酸乙酯酵母菌株进行形态学观察和生理生化试验。
分子生物学鉴定:通过M5超光速mix(MF848)试剂盒提取高产乙酸乙酯酵母菌的脱氧核糖核酸(deoxyribonu cleic acid,DNA),并以其为模板,采用内转录间隔区(internal transcribed spacer,ITS)通用引物ITS1(5'-GCA CAA TAA GCG GAG GAA AAG-3')和ITS4(5'-GGT CCG TGT TTC AAG ACG G-3')对酵母菌的ITS基因序列进行PCR扩增。PCR扩增体系:M5 HiPer plus Taq HiFi PCR Mix 10.0 μL;引物ITS1和ITS4各0.5 μL;DNA模板1.0 μL;双蒸水(ddH2O)13 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性25 s;60 ℃退火25 s;72 ℃延伸10 s,共34次循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,选取同源性较高的模式菌株的ITS基因序列,采用MEGA 5软件中的邻接法(neighbor-joining,NJ)构建系统发育树以获得分子系统发育信息,鉴定分离株的种属分类。
1.3.3 发酵产乙酸乙酯条件优化
(1)单因素试验
在1.3.1的基础上,以乙酸乙酯产量为评价指标,依次探究碳源种类(葡萄糖、蔗糖、果糖、麦芽糖)及最适碳源添加量(40 g/L、60 g/L、80 g/L、100 g/L、120 g/L),氮源种类(酵母粉、蛋白胨、牛肉粉、硫酸铵、氯化铵)及最适氮源添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L),初始pH值(3、4、5、6、7、8),接种量(3%、6%、9%、12%、15%),培养时间(24 h、48 h、72 h、96 h)共7个因素对筛选酵母菌株产乙酸乙酯的影响。
(2)Plackett-Burman(PB)法筛选试验
根据单因素试验结果,对葡萄糖添加量(A)、酵母粉添加量(B)、初始pH值(C)、发酵时间(D)、接种量(E)进行PB试验设计,以筛选影响乙酸乙酯产量的重要变量,PB试验设计因素与水平见表1。
表1 产乙酸乙酯发酵条件优化PB试验设计因素与水平
Table 1 Factors and levels of PB tests design for optimization of fermentation conditions for ethyl acetate production

因素A 葡萄糖添加量/(g·L-1)B 酵母粉添加量/(g·L-1)C 初始pH值D 发酵时间/h E 接种量/%水平-1 1 60 15 4 24 3 100 25 8 72 9
(3)响应面法优化
根据PB试验筛选显著因子,确定葡萄糖添加量(A)、酵母粉添加量(B)、初始pH值(C)为主要的3个影响因子,以这3个影响因子为自变量,乙酸乙酯产量(Y)为响应值,采用Design-expert 13设计3因素3水平的Box-Behnken(BB)响应面试验,BB试验因素与水平见表2。
表2 发酵条件优化响应面试验因素与水平
Table 2 Factors and Levels of response surface tests for optimization of fermentation conditions
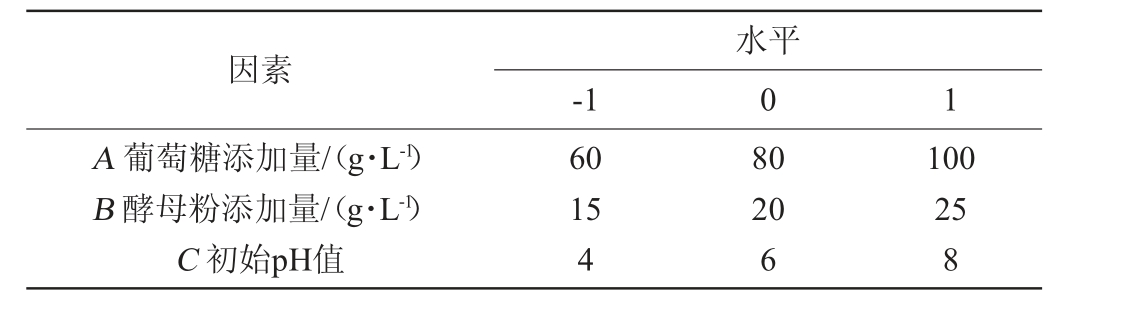
因素A 葡萄糖添加量/(g·L-1)B 酵母粉添加量/(g·L-1)C 初始pH值水平-1 0 1 60 15 4 80 20 6 100 25 8
1.3.4 统计分析
使用方差分析(ANOVA)和Tukey检验分析评估组间的统计学差异,每个处理至少3个生物学重复,结果用“平均值±标准差”表示。应用Design-Expert13、SPSS26.0、OriginPro 9.5进行响应面试验设计及数据处理和分析。
2 结果与分析
2.1 高产乙酸乙酯酵母菌的分离及筛选
从浓香型白酒酒醅样品中共分离筛选到10株能够产生乙酸乙酯的酵母菌,其乙酸乙酯产量测定结果见表3。由表3可知,10株酵母菌株的乙酸乙酯产量为0.57~1.96 g/L,其中菌株Q5-1的乙酸乙酯产量最高,为1.96 g/L,因此,将其作为高产乙酸乙酯的菌株。
表3 10株酵母菌的乙酸乙酯产量测定结果
Table 3 Determination results of ethyl acetate production of 10 yeast strains

菌株编号 乙酸乙酯产量/(g·L-1) 菌株编号 乙酸乙酯产量/(g·L-1)Z2-8 Z3-1 Q1-6 Z1-3 Q5-1 0.59±0.01 0.57±0.10 0.99±0.09 1.49±0.02 1.96±0.15 Q5-3 Q6-3 Q5-4 Q6-2 Q5-5 1.60±0.07 1.09±0.13 1.73±0.19 1.15±0.15 1.46±0.05
2.2 菌株Q5-1的鉴定
2.2.1 形态学观察
菌株Q5-1的菌落形态及扫描电镜结果见图1。由图1A可知,菌株Q5-1在YPD培养基上的菌落为乳白色、凸起、表面湿润光滑、边缘规则,有较浓郁的香味。由图1B可知,菌株Q5-1的细胞呈卵圆形或圆形,多边出芽生殖,具有典型的酵母形态。
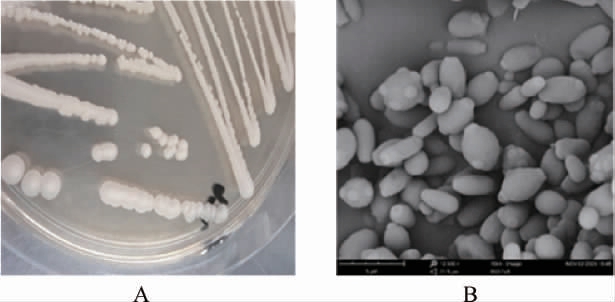
图1 菌株Q5-1在YPD上的菌落形态(A)和电镜扫描结果(B)
Fig.1 Colony morphology (A) of strain Q5-1 on YPD medium and electron microscope scanning results (B)
2.2.2 生理生化试验
菌株Q5-1的生理生化试验结果见表4。由表4可知,菌株Q5-1可利用D-葡萄糖、D-蔗糖、D-麦芽糖、D-果糖生长,但不能利用D-山梨醇、D-甘露醇、D-乳糖和可溶性淀粉;可利用氯化铵和硫酸铵作为唯一氮源生长,但不能利用亚硝酸钠、尿素和硝酸钾生长。结合形态特征,参照《酵母菌的特征与鉴定手册》[23]将菌株Q5-1初步鉴定为威克汉姆酵母属(Wickerhamomyces sp.)。
表4 菌株Q5-1的生理生化特性
Table 4 Physiological and biochemical characteristics of strain Q5-1
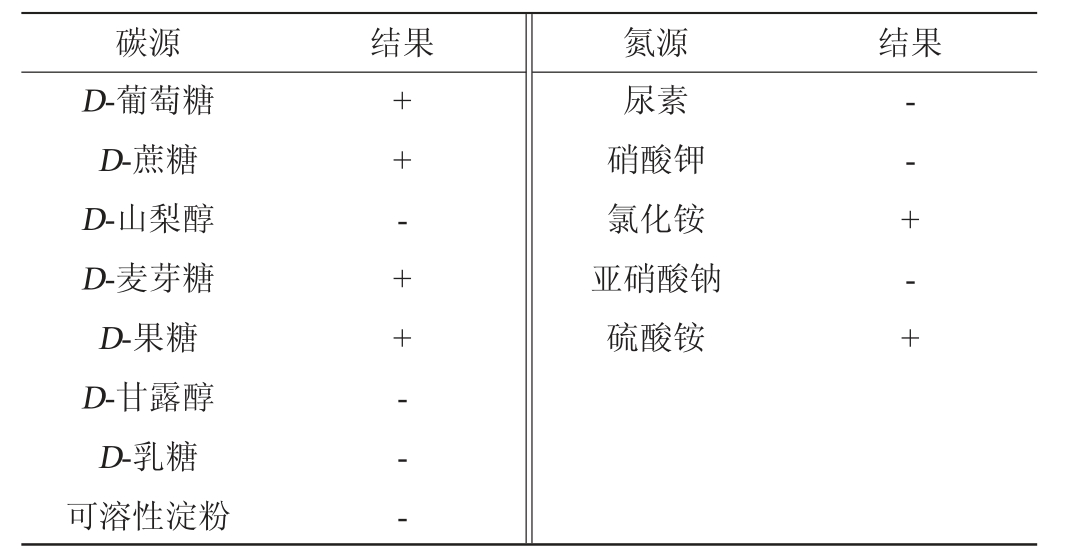
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
碳源 结果 氮源 结果D-葡萄糖D-蔗糖D-山梨醇D-麦芽糖D-果糖D-甘露醇D-乳糖可溶性淀粉++ - + + - - -尿素硝酸钾氯化铵亚硝酸钠硫酸铵-- + - +
2.2.3 分子生物学鉴定
基于ITS基因序列,构建菌株Q5-1的系统发育树,结果见图2。由图2可知,菌株Q5-1与模式菌株异常威克汉姆酵母(Wickerhamomyces anomalus)CBS5759聚于一支,亲缘关系最近,同源性高达99.44%。结合形态学特征及生理生化试验结果,最终鉴定菌株Q5-1为异常威克汉姆酵母(Wickerhamomyces anomalus)。
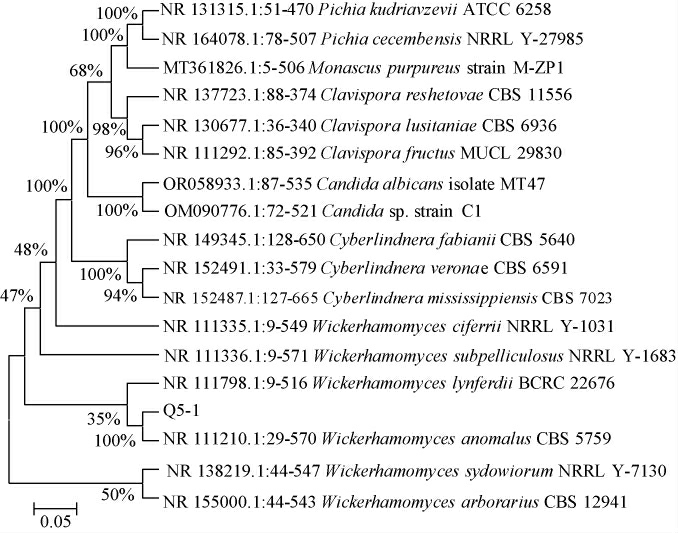
图2 基于ITS基因序列菌株Q5-1的系统发育树
Fig.2 Phylogenetic tree of strain Q5-1 based on ITS gene sequences
2.3 异常威克汉姆酵母Q5-1产乙酸乙酯发酵条件优化单因素试验
2.3.1 不同碳源及添加量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
碳源可以为酵母菌的生长和代谢提供能量,但其种类、浓度会影响酵母的生长速度和代谢途径及强度[24-25]。因此,选择适宜的碳源及添加量进行发酵才更有利于产酯。不同碳源及添加量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响见图3。由图3a可知,菌株Q5-1以葡萄糖为碳源时,乙酸乙酯产量最高,为1.83 g/L,显著高于以蔗糖、果糖和麦芽糖为碳源的乙酸乙酯产量(P<0.05),分析原因可能是,相比蔗糖(二糖)和麦芽糖(多糖),葡萄糖和果糖更容易被微生物代谢利用,特别是葡萄糖[26-27]。因此,确定最佳碳源为葡萄糖。由图3b可知,随着葡萄糖添加量的增加,乙酸乙酯的产量呈先升高后下降的趋势,当葡萄糖添加量为80 g/L时,乙酸乙酯产量达到最高,为1.97 g/L,因此,确定最适葡萄糖添加量为80 g/L。
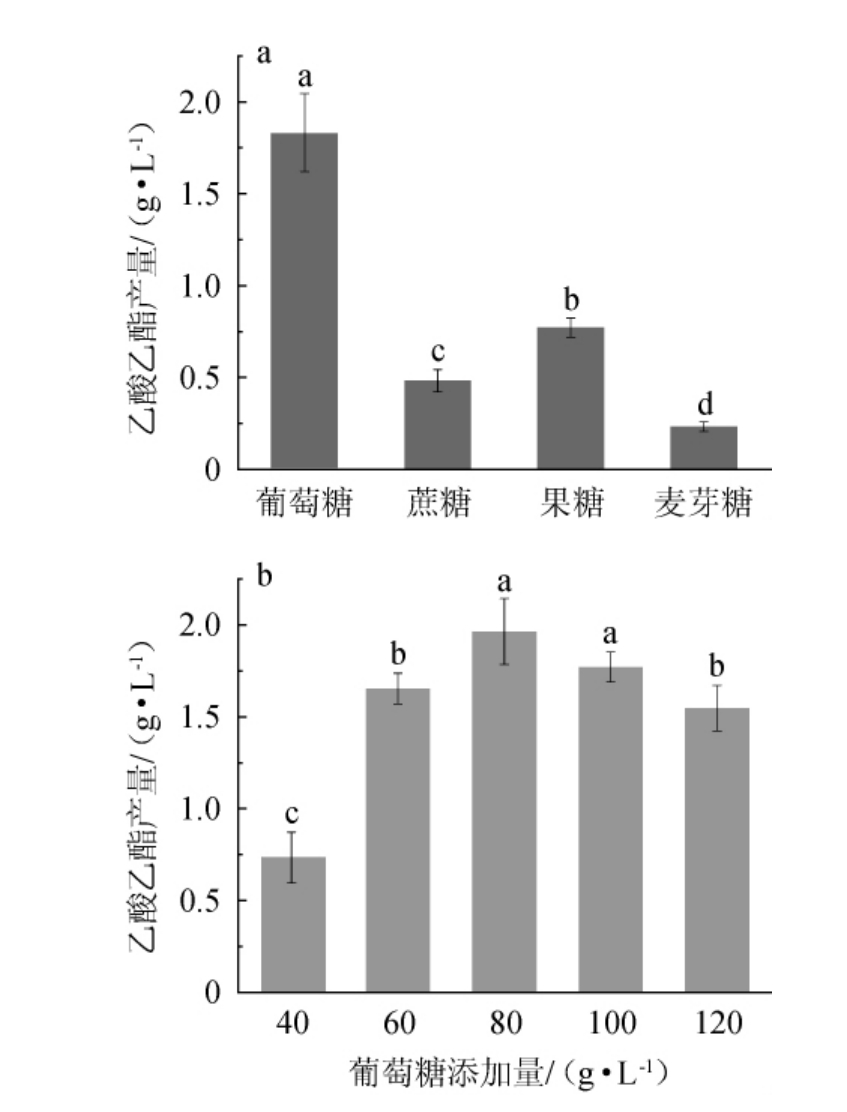
图3 不同碳源(a)和葡萄糖添加量(b)对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
Fig.3 Effect of different carbon sources (a) and glucose additions (b)on ethyl acetate production by Wickerhamomyces anomalus Q5-1
不同小写字母表示差异显著(P<0.05)。下同。
2.3.2 不同氮源及添加量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
不同氮源及添加量对异常威客汉姆酵母对Q5-1产乙酸乙酯的影响见图4。由图4a可知,有机氮(酵母粉、蛋白胨和牛肉粉)比无机氮(碳酸氨和氯化氨)更有利于异常威克汉姆酵母Q5-1的产酯代谢,其中,以酵母粉为唯一氮源时,乙酸乙酯产量达到2.56 g/L,显著高于其他氮源(P<0.05)。这可能是酵母粉含有大量的生长因子,如氨基酸、维生素和微量元素,这些生长因子有利于酵母的生长和代谢物的积累[28-30]。但是,过量的氮源会使细胞快速生长而使底物消耗过多,导致乙酸乙酯积累减少[30]。因而,适宜的氮源添加量才能充分保证微生物的产酯效率。由图4b可知,随着酵母粉添加量的增加,异常威克汉姆酵母Q5-1的乙酸乙酯产量呈先升高后下降的趋势。当酵母粉添加量为20 g/L时,乙酸乙酯的产量最高,为3.49 g/L,因此,确定酵母粉的最佳添加量为20 g/L。
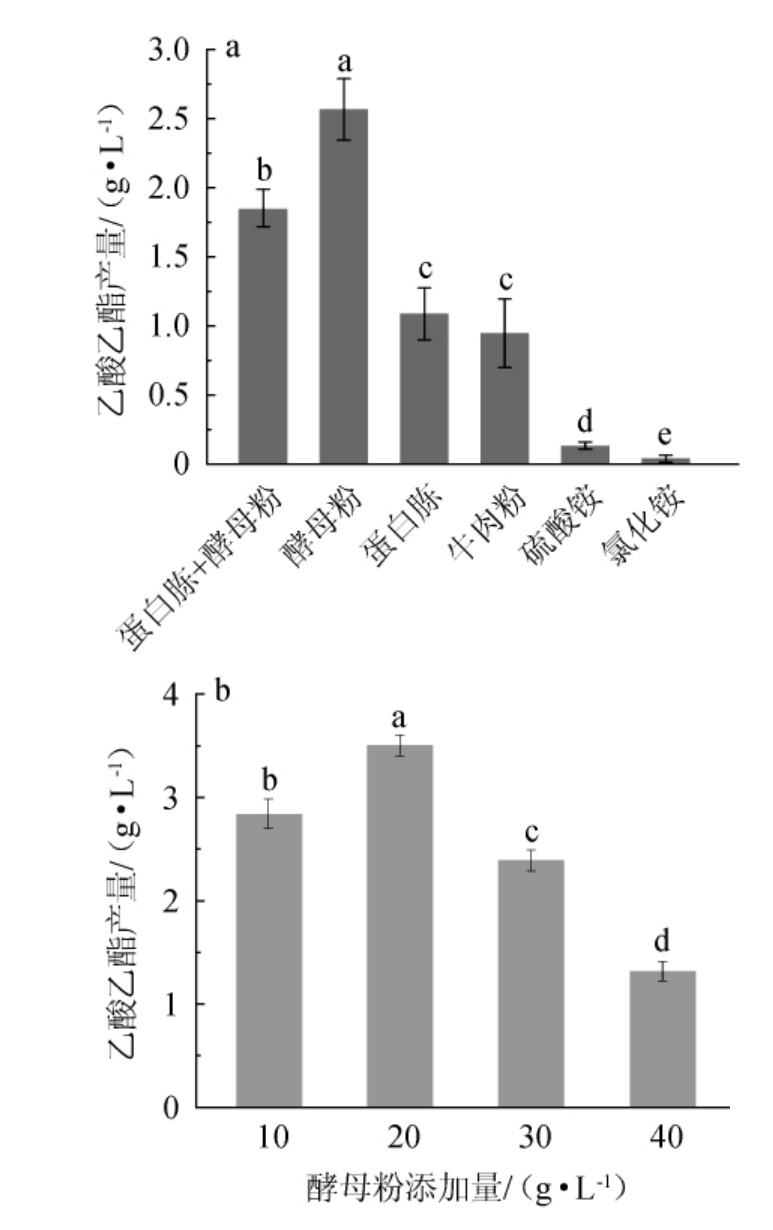
图4 不同氮源(a)和酵母粉添加量(b)对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
Fig.4 Effect of different nitrogen sources (a) and yeast extract additions (b) on ethyl acetate production by Wickerhamomyces anomalus Q5-1
2.3.3 初始pH值对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
环境pH值会改变细胞膜的渗透性和酶的活性,也会改变体系内营养物质的状态,从而影响微生物对营养物质的利用,导致微生物的生长状态和产物不同[31-32]。酵母菌在适应环境pH变化时会代谢应激反应,导致代谢产物的类型或产量也会有所不同[33]。不同初始pH值对异常威客汉姆酵母Q5-1产乙酸乙酯的影响见图5。由图5可知,乙酸乙酯产量随着初始pH值的升高呈先上升后下降的趋势,当初始pH值为5~6时,乙酸乙酯产量显著高于其他pH条件(P<0.05),表明pH为5.0~6.0的弱酸性条件更有利于异常威克汉姆酵母Q5-1的产酯代谢,这与其他微生物合成乙酸乙酯的最适pH值(4.0~4.5)不相同[2]。当初始pH值为6时,乙酸乙酯产量最高,为4.29 g/L,与刘薇等[34]报道一致,故确最佳初始pH值为6。
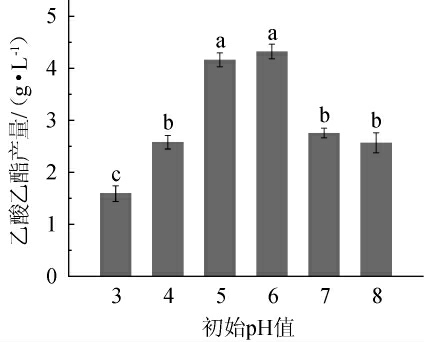
图5 初始pH值对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
Fig.5 Effect of initial pH on ethyl acetate production by Wickerhamomyces anomalus Q5-1
2.3.4 接种量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
接种量是研究微生物发酵过程的重要因素,它不仅影响目标产物的产量,而且影响发酵周期[35]。不同接种量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响见图6。由图6可知,随着接种量的增加,乙酸乙酯的产量呈现先上升后下降的趋势。当接种量为6%时,乙酸乙酯产量最高,为4.62 g/L。这可能是由于接种量的增加,大量酵母菌的快速繁殖导致过多消耗营养底物或氧气供应不足,抑制了酯类化合物的产生和积累;但是,较小的接种量可能会延迟发酵的开始,并增加发酵过程的时间和成本[35-36]。因此,确定最佳接种量为6%。
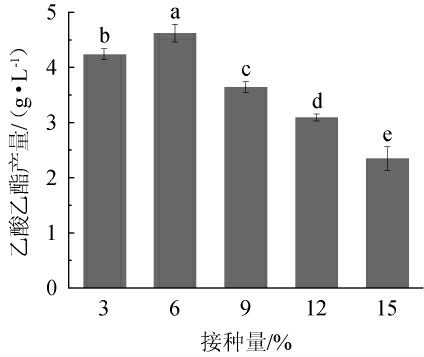
图6 接种量对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
Fig.6 Effect of inoculum on ethyl acetate production by Wickerhamomyces anomalus Q5-1
2.3.5 发酵时间对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
发酵时间是控制酵母菌株产乙酸乙酯的重要因素之一,如异常汉逊酵母(Hansenula anomala)在发酵初期大量累积乙酸乙酯,但随着发酵时间延长,乙酸乙酯倾向水解,乙酸乙酯累积量则大幅度降低[37]。不同发酵时间对异常威客汉姆酵母Q5-1产乙酸乙酯的影响见图7。由图7可知,随着发酵时间的延长,乙酸乙酯产量呈先升高后下降的趋势,当发酵时间为48 h时,乙酸乙酯产量达到最高,为4.56 g/L。分析原因可能是发酵前期酵母Q5-1处于对数生长期,生长代谢旺盛,产乙酸乙酯能力强,发酵48 h后,生产代谢变缓,产乙酸乙酯能力降低;乙酸乙酯是积累和分解是同时进行的,当其大量累积而产酯速率下降时,乙酸乙酯则倾向水解,乙酸乙酯累积量则会大幅度降低[20,37]。因此,确定最佳发酵时间为48 h。
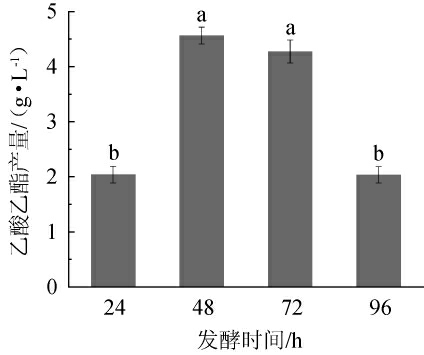
图7 发酵时间对异常威克汉姆酵母Q5-1产乙酸乙酯的影响
Fig.7 Effect of fermentation time on ethyl acetate production by Wickerhamomyces anomalus Q5-1
2.4 异常威克汉姆酵母Q5-1产乙酸乙酯发酵条件优化Plackett-Burman试验
根据单因素试验结果,对葡萄糖添加量(A)、酵母粉添加量(B)、初始pH(C)、发酵时间(D)、接种量(E)进行进行PB试验设计,筛选出对乙酸乙酯产量影响较大的因素,PB试验设计及结果见表5,方差分析见表6。
表5 Plackett-Burman试验设计及结果
Table 5 Design and results of Plackett-Burman tests
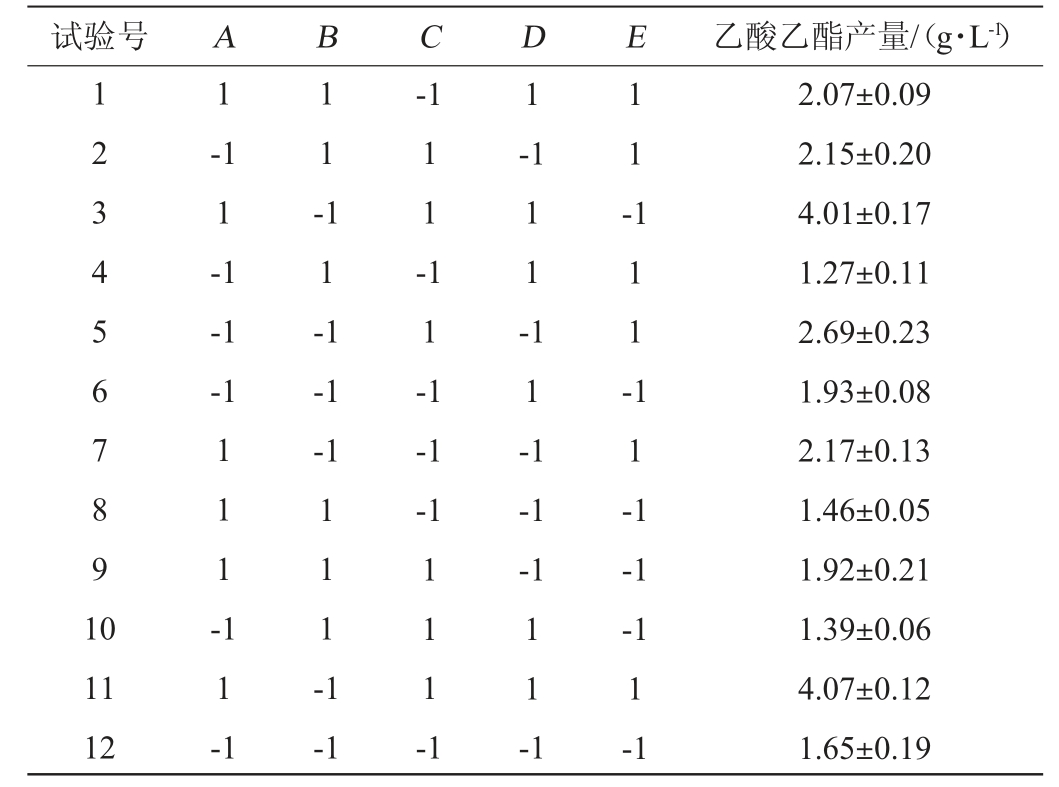
试验号 A B C D E 乙酸乙酯产量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 1-1 1-1 1-1-1-1 1 1 --1 1 1 -1 1 1 -1 1 -1 1 -1 1 1 -1 1 -1 1 1 1 --1-1-1-1 1 1 -1-1-1 1 1 -1 11 12 1 1 -1 1 1 1 -1-1 1 1 1 -1 1 1 -1-1-1 1-1 2.07±0.09 2.15±0.20 4.01±0.17 1.27±0.11 2.69±0.23 1.93±0.08 2.17±0.13 1.46±0.05 1.92±0.21 1.39±0.06 4.07±0.12 1.65±0.19
表6 Plackett-Burman试验结果方差分析
Table 6 Variance analysis of Plackett-Burman test results
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。下同。
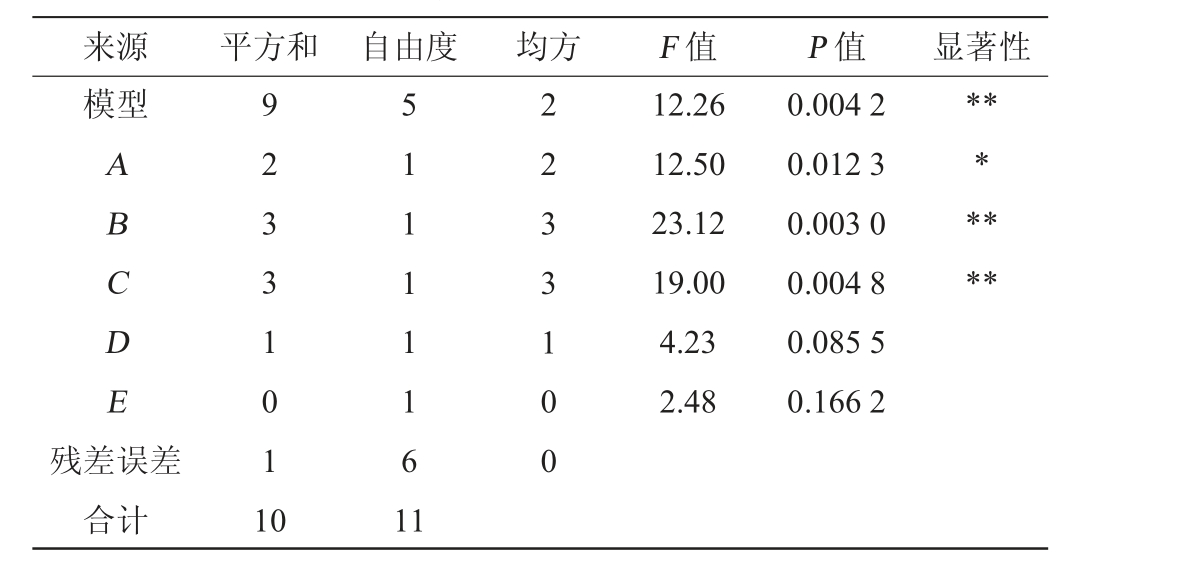
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCDE 12.26 12.50 23.12 19.00 4.23 2.48 0.004 2 0.012 3 0.003 0 0.004 8 0.085 5 0.166 2*******残差误差合计9 2 3 3 1 0 1 1 0 5 1 1 1 1 1 6 1 1 2 2 3 3 1 0 0
采用Design-Expert 13对表5试验结果进行回归拟合,得到回归方程:Y=2.23+0.383 9A-0.522 2B+0.473 3C+0.223 3D+0.171 1E。
由表6可知,模型的决定系数(R2)为0.910 5,P值=0.004 2,表明该模型可靠。由表6亦可知,酵母粉添加量及初始pH值对异常威克汉姆产乙酸乙酯的影响极显著(P<0.01),葡萄糖添加量对异常威克汉姆产乙酸乙酯的影响显著(P<0.05),其他因素对结果影响不显著(P>0.05),因此,选择葡萄糖、酵母粉、初始pH值进行响应面优化试验设计。
2.5 异常威克汉姆酵母Q5-1产乙酸乙酯发酵条件优化响应面试验
2.5.1 响应面试验结果及方差分析
在单因素试验及PB试验的基础上,确定葡萄糖添加量(A)、酵母粉添加量(B)、初始pH值(C)为主要的3个影响因子,以这3个影响因子为考察因素,乙酸乙酯产量(Y)为响应值,采用Design-Expert 13设计3因素3水平的Box-Behnken响应面试验,试验设计与结果见表7,方差分析见表8。
表7 发酵条件优化响应面试验设计与结果
Table 7 Design and results of response surface tests for optimization of fermentation conditions
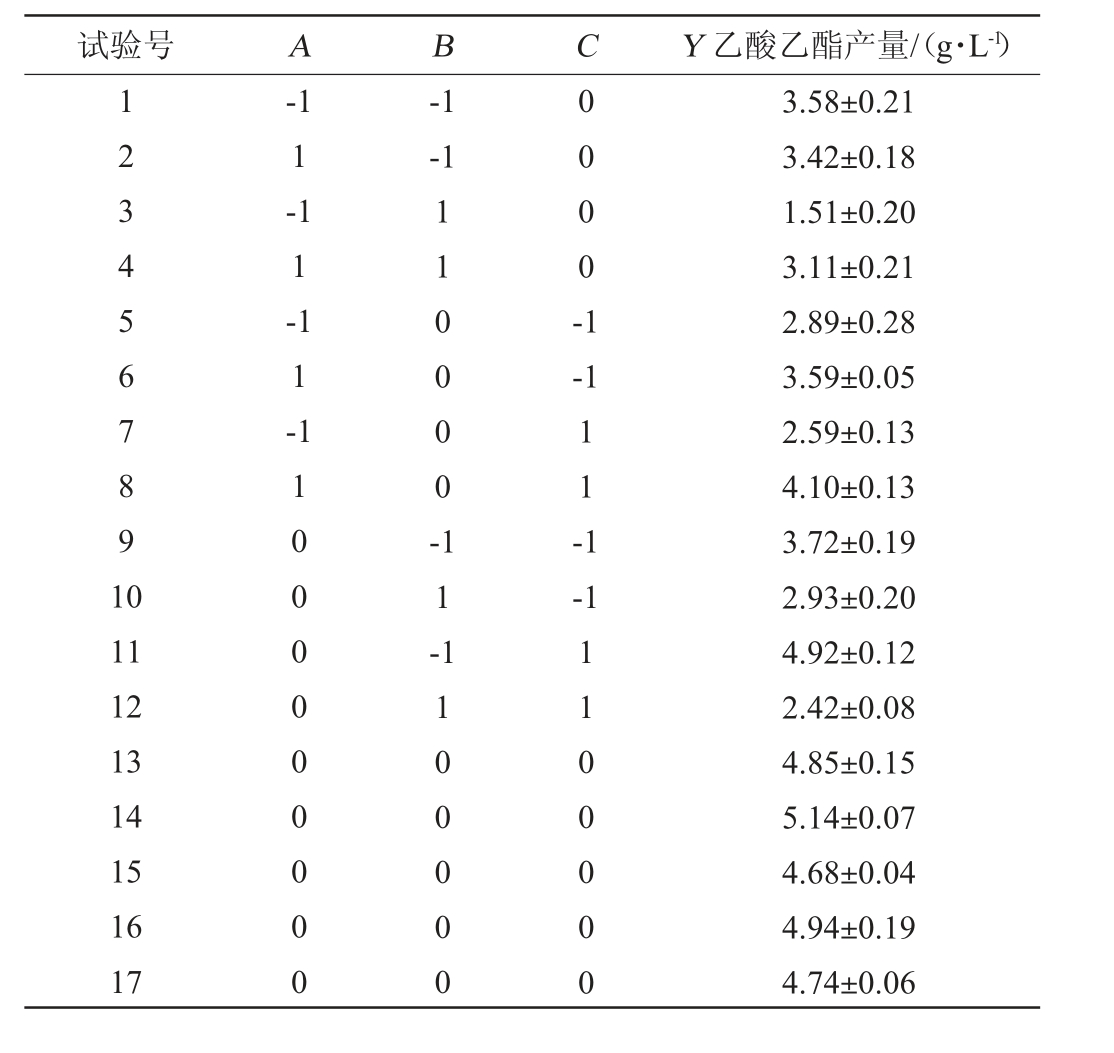
试验号 A B C Y 乙酸乙酯产量/(g·L-1)1234567891 0-1 1-1 1-1 1-1-1-1 110000-0000-1-1 1 1 -1-1 11 12 13 14 15 16 17 1000000000 1 1 -1100000 1100000 3.58±0.21 3.42±0.18 1.51±0.20 3.11±0.21 2.89±0.28 3.59±0.05 2.59±0.13 4.10±0.13 3.72±0.19 2.93±0.20 4.92±0.12 2.42±0.08 4.85±0.15 5.14±0.07 4.68±0.04 4.94±0.19 4.74±0.06
表8 回归模型方差分析
Table 8 Variance analysis of regression model
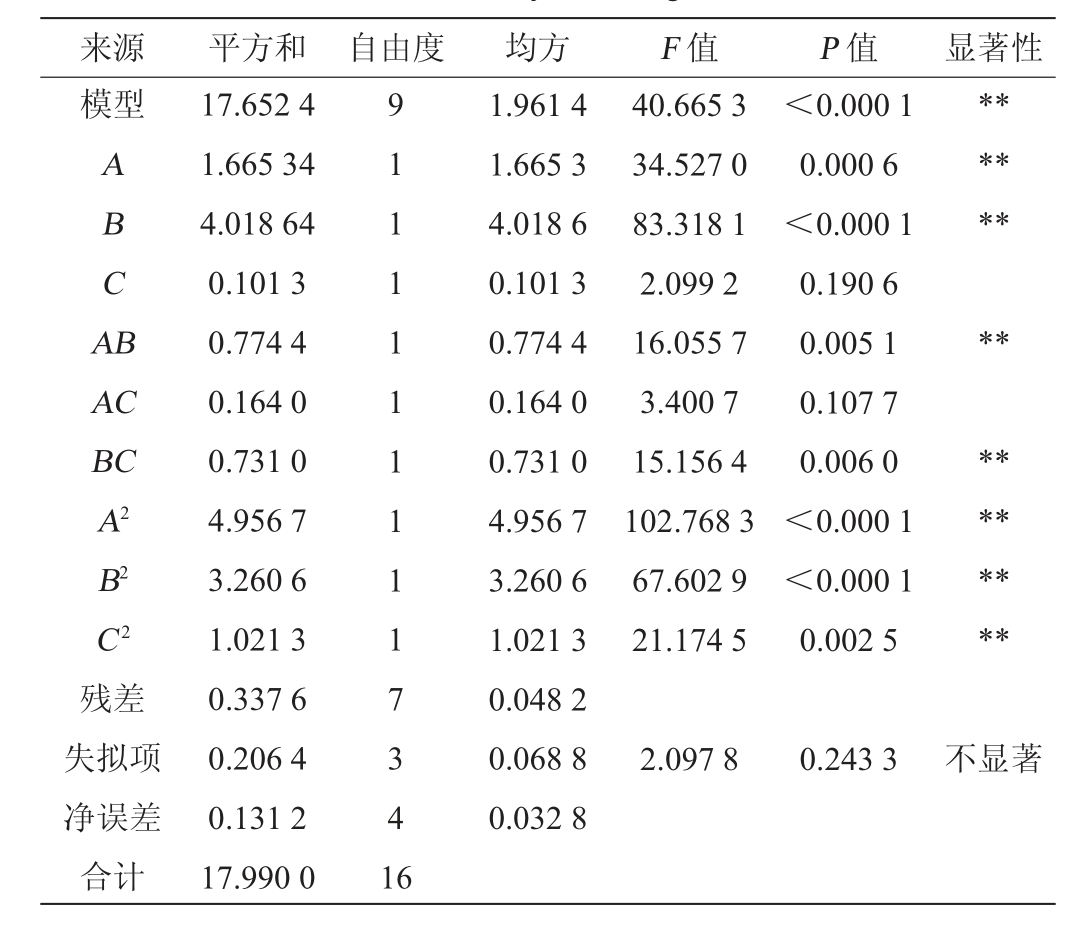
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2 40.665 3 34.527 0 83.318 1 2.099 2 16.055 7 3.400 7 15.156 4 102.768 3 67.602 9 21.174 5<0.000 1 0.000 6<0.000 1 0.190 6 0.005 1 0.107 7 0.006 0<0.000 1<0.000 1 0.002 5********残差失拟项净误差合计17.652 4 1.665 34 4.018 64 0.101 3 0.774 4 0.164 0 0.731 0 4.956 7 3.260 6 1.021 3 0.337 6 0.206 4 0.131 2 17.990 0 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 1.961 4 1.665 3 4.018 6 0.101 3 0.774 4 0.164 0 0.731 0 4.956 7 3.260 6 1.021 3 0.048 2 0.068 8 0.032 8 2.097 8 0.243 3不显著
采用Design-Expert 13对表7数据进行多元二次回归拟合分析,得到的二次多项回归方程为:
由表8可知,模型P<0.000 1,极显著;失拟项P=0.319 5>0.05,不显著,说明模型可靠。变异系数(coefficient of variation,CV)值较低,为5.91%,表明模型的可靠性较高。决定系数R2=0.981,调整决定系数R2adj=0.957,说明该方程对试验拟合性较好,模型能解释98.1%响应值的变化,乙酸乙酯生成有95.71%的样本变异归因于自变量。由表8亦可知,一次项A、B,交互项AB、BC,二次项A2、B2、C 2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。
响应面模型直观反映了各因素间交互作用对异常威客汉姆酵母Q5-1产乙酸乙酯的影响,结果见图8。由图8可知,响应面均呈凸面,均存在最大值;交互项AB、BC的等高线呈椭圆形,交互项AC的等高线呈圆形,说明AB、BC对乙酸乙酯产量影响较大,而AC对乙酸乙酯产量影响较小,这与表8的方差分析结果一致。
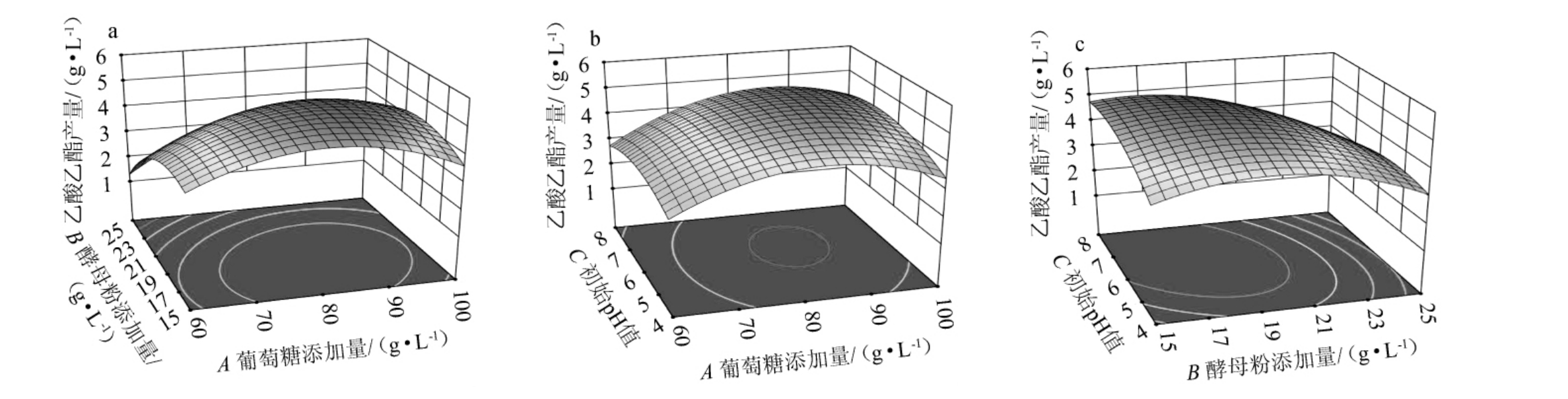
图8 各因素间交互作用对乙酸乙酯产量影响的响应曲面及等高线
Fig.8 Response surface plots and contour lines of the effect of interaction between each factors on ethyl acetate yield
2.5.2 最佳发酵条件的确定及验证
采用Design-Expert 13对二次多元回归方差求解,得到最佳发酵条件为:葡萄糖添加量为98.05 g/L、酵母粉添加量为18.65 g/L、初始pH值为6.80。此条件下,模型预测值乙酸乙酯产量为4.52 g/L。为便于实际操作,将最优发酵条件下修订为:葡萄糖添加量98 g/L、酵母粉添加量19 g/L、初始pH值为6.8。在此条件下进行3次重复验证试验,结果乙酸乙酯产量实际值为4.89 g/L,与预测值(4.52 g/L)相近,表明所建模型拟合良好且可靠。在优化条件下,异常威克汉姆酵母Q5-1的乙酸乙酯产量是优化前(1.96 g/L)的2.49倍。
3 结论
本研究采用传统培养分离法及乙酸乙酯产量测定从浓香型白酒酒醅中分离筛选得到一株高产乙酸乙酯的酵母菌,编号为Q5-1,通过形态学观察、生理生化试验和ITS序列分析鉴定该菌株为异常威克汉姆酵母(Wickerhamomyces anomalus)。通过单因素试验、PB试验和响应面试验优化得到菌株Q5-1产乙酸乙酯的最优发酵条件为葡萄糖98 g/L、酵母粉19 g/L、初始pH 6.8、接种量6%、发酵时间48 h。在此优化条件下,菌株Q5-1的乙酸乙酯产量达到4.89 g/L,是优化前的2.49倍,为开发高效产酯酵母菌剂及工业化应用提供理论及应用支持。
[1]谢再斌,王太玉,王茜,等.异常威克汉姆酵母在白酒酿造中的应用研究[J].中国酿造,2022,41(5):18-22.
[2]肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.
[3]MENENDEZ-BRAVO S,COMNA S,GRAMAJO H,et al.Metabolic engineering of microorganisms for the production of structurally diverse esters[J].Appl Microbiol Biot,2017,101(8):3043-3053.
[4]ZHANG S,GUO F,YAN W,et al.Perspectives for the microbial production of ethyl acetate[J].Appl Microbiol Biotechnol,2020,104(17):7239-7245.
[5]TAI Y S,XIONG M Y,ZHANG K C.Engineered biosynthesis of mediumchain esters in Escherichia coli[J].Metab Eng,2015,27:20-28.
[6]SU L,HONG R,GUO X,et al.Short-chain aliphatic ester synthesis using Thermobifida fusca cutinase[J].Food Chem,2016,206:131-136.
[7]KRIS A J, BOHNENKAMP A C, PATINATINIOS C, et al.Microbial production of short and medium chain esters: Enzymes, pathways, and applications[J].Biotechnol Adv,2019,37(7):107407.
[8]陆家声,章晓宇,蒋羽佳,等.短链脂肪酸酯生物合成研究进展[J].生物学杂志,2021,38(4):1-11.
[9]VANDAMME E J, SOETAERT W.Bioflavors and fragrances via fermentation and biocatalysis[J].J Chem Technol Biot,2002,77(12):1323-1332.
[10]KARIM A, GERLIANI N, Aïder M.Kluyveromyces marxianus: An emerging yeast cell factory for applications in food and biotechnology[J].Int J Food Microbiol,2020,333:108818.
[11]GARAVAGLIA J,SCHNEIDER R C,CAMARGO M S D,et al.Evaluation of Zygosaccharomyces bailii BCV 08 as a co-starter in wine fermentation for the improvement of ethyl esters production[J].Microbiol Res,2015,173:59-65.
[12]张杰,程伟,巩子路,等.一株高产乙酸乙酯酵母菌的筛选及其鉴定[J].酿酒,2018,45(6):59-62.
[13]陈雪,孟勤燕,齐欢,等.高产乙酸乙酯酵母菌株的筛选[J].酿酒科技,2020(1):96-102.
[14]李泽洋,伍时华,龙秀锋,等.米酒生香酵母的分离筛选鉴定及其性能研究[J].食品与发酵工业,2021,47(7):43-50.
[15]贾丽艳,田宇敏,荆旭,等.清香风味导向的酿酒酵母Y2的分离鉴定及生物学特性研究[J].中国食品学报,2020,20(1):230-236.
[16]李景辉,郭莹,张颖,等.高产酯菌株的筛选及其在酱香型白酒堆积发酵中的应用[J].中国酿造,2021,40(10):168-173.
[17]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[18]汪晗,高瑞杰,杨团元,等.白酒酿造中低产高级醇酿酒酵母的筛选及应用研究[J].中国酿造,2023,42(8):78-83.
[19]FAN G S,TENG C,XU D,et al.Enhanced production of ethyl acetate using co-culture of Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].J Biosci Bioeng,2019,128(5):564-570.
[20]邢爽,王亚平,郭学武,等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[21]ZHANG Y Y,ZHU X Y,LI X Z,et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strongflavored liquor[J].BMC Microbiol,2017,17:196.
[22]FAN G S, SUN B G, XU C, et al.Isolation and identification of highyield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].J Am Soc Brew Chem,2018,76(2):117-124.
[23]巴尼特,佩恩·亚罗,胡瑞卿(译).酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:1-52.
[24]KOH M,SUN J C,LIU S.Optimization of L-methionine bioconversion to aroma-active methionol by Kluyveromyces lactis using the Taguchi method[J].J Field Robotics,2013,2(4):90-100.
[25]石馨.异常威客汉姆酵母Y-1的产酯酶特性及其在酿酒中的应用[D].郑州:河南工业大学,2022.
[26]朱豫,曹海龙,李曙光,等.发酵过程中微生物利用不同单糖的差异性[J].中国生物工程杂志,2009,29(9):102-107.
[27]DUAN S F,SHI J Y,YIN Q,et al.Reverse evolution of a classic gene network in yeast offers a competitive advantage[J].Curr Biol,2019,29(7):1126-1136.
[28]FAN G S,CHENG L J,FU Z L,et al.Screening of yeasts isolated from Baijiu environments for 2-phenylethanol production and optimization of production conditions[J].3 Biotech,2020,10(6):275.
[29]BARBOSA C,MENDES-FAIA A,MENDES-FERREIRA A.The nitrogen source impacts major volatile compounds released by Saccharomyces cerevisiae during alcoholic fermentation[J].Int J Food Microbiol,2012,160(2):87-93.
[30]MEI BEI QUEK J,SEOW Y X,Ong P K C,et al.Formation of volatile sulfur-containing compounds by Saccharomyces cerevisiae in soymilk supplemented with L-methionine[J].Food Biotechnol,2011,25(4):292-304.
[31]FAN G S,LIU P X,XU C,et al.Isolation and Identification of a highyield ethyl caproate-producing yeast from Daqu and optimization of its fermentation[J].Front Microbiol,2021,12:663744.
[32]KURLWICH T A,SACHS G,PADAN E.Molecular aspects of bacterial pH sensing and homeostasis[J].Nat Rev Microbiol,2011,9(5):330-343.
[33]MA J H, CHENG L J, ZHANG Y J, et al.Screening of yeasts isolated from Baijiu environments for producing 3-methylthio-1-propanol and optimizing production conditions[J].Foods,2022,11(22):3616.
[34]刘薇,栾春光,王德良,等.高产酯酵母的筛选、鉴定及其发酵特性研究[J].食品与发酵工业,2021,47(23):311-318.
[35]FAN G S,LIU P X,WU Q H,et al.Optimization of cultural conditions for ethyl alcohol production by Saccharomyces cerevisiae YF1914 in aerobic conditions and its aroma-producing characteristics[J].Sci Technol Food Ind,2019,40(13):52-58.
[36]DUAN G F,LIU Y Y,LV H L,et al.Optimization of"Zaoheibao"wine fermentation process and analysis of aroma substances[J].Biotech Biotechnol Equipment,2020,34(1):1056-1064.
[37]李锐利.高产乙酸乙酯酵母的选育及在清香型小曲酒中的应用研究[D].武汉:湖北工业大学,2011.