枇杷(Eriobotrya japonica)叶为蔷薇科植物枇杷的干燥叶,中国药典记载其有“清肺止咳,降逆止呕”之功效[1]。研究显示,枇杷叶富含多糖类[2]、多酚类[3]、三萜酸类[4]、有机酸类、挥发油类活性成分[5-8]众多活性成分使枇杷叶呈现各种功效。陈剑等[9]研究发现,6种枇杷叶三萜酸经菌群转化后有降血糖增效作用;MOGOLE L等[10]研究发现,枇杷叶提取物对α-淀粉酶有较好的抑制作用;雒江菡等[11]优化了枇杷叶多糖的提取工艺,并证实枇杷叶多糖对大肠杆菌(Escherichia coli)有较好的抑菌效果;KIM T M等[12]评估了枇杷叶水提物在卵清蛋白诱导的小鼠哮喘模型和人气管平滑肌细胞中的抗炎活性,并对其表达机制进行了探讨;幸晓清等[13]的研究证实,枇杷叶提取物富含酚类、黄酮类物质,这些成分通过清除自由基来抑制脂质氧化,可用于冷却肉的保鲜;JIAN T Y等[14-15]的研究则证实了枇杷叶对慢性阻塞性肺病小鼠的抗氧化应激和抗炎作用是通过总黄酮和三萜酸来实现的。
高糖饮食是指通过饮食摄入了大量的葡萄糖、果糖等添加糖。研究证实,高糖饮食会导致代谢紊乱,诱发肥胖、糖尿病、非酒精性脂肪肝、肠炎等疾病,还会加剧近视的进程,促进多种肿瘤的发生和生长[16]。LI M等[17]研究显示,高糖饮食会导致黑腹果蝇(Drosophila melanogaster)肥胖、代谢紊乱以及整体寿命缩短,转变饮食构成(在任何年龄)能对健康起到积极作用;ZHANG L等[18]借助美国国家健康与营养调查数据库对18 439位成年人进行分析,发现膳食糖摄入量每天增加100 g,抑郁症患病率就会增加28%;中国医药教育协会[19]调查认为,溃疡性结肠炎、克罗恩病等炎症性肠病的发生与高糖饮食的生活方式密切相关;HOCHREIN S M等[20]研究显示,长期、过量摄入富含糖分和碳水化合物的食物会诱发炎症和各种慢性疾病;LAFFIN M等[21]研究显示,即使是短期的(2 d)高糖饮食,也会导致肠道微生物多样性降低、短链脂肪酸减少、肠道通透性增加,并最终导致结肠炎易感性的增加。模式生物黑腹果蝇的肠道可分为前肠、中肠和后肠及马氏管,结构和功能都与哺乳动物高度相似。黑腹果蝇肠道微生物组成相对简单,非内生菌群通过环境因素进行传播,饮食因素对核心菌群的影响较大[22-23]。肠道菌群的异常增殖会导致黑腹果蝇代谢失调,通过诱发活性氧的产生促进黑腹果蝇的衰老进程[24]。
本研究以黑腹果蝇(Drosophila melanogaster)为研究对象,构建高糖饮食诱导的代谢紊乱模型,设置基础培养基、高糖培养基和分别添加1%、5%、10%枇杷叶提取物的含药培养基对黑腹果蝇进行培养,考察枇杷叶提取物对各实验组黑腹果蝇平均寿命、蛹化率、羽化率等生长发育性能的影响;通过检测各组黑腹果蝇肠道样本的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量考察枇杷叶提取物对黑腹果蝇抗氧化性能的影响;通过蓝精灵(Smurf)实验检测枇杷叶提取物对黑腹果蝇肠道完整性的影响。在16S rRNA测序的基础上,对各组黑腹果蝇肠道微生物进行α多样性分析、β多样性分析、线性判别分析(linear discriminant analysis,LDA),考察枇杷叶提取物对黑腹果蝇肠道微生物多样性的影响。旨在初步探讨枇杷叶提取物缓解黑腹果蝇代谢紊乱的作用机制,为枇杷叶相关产品的后续开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料枇杷叶:购自张仲景大药房;野生型黑腹黑果蝇:信阳农林学院药学院实验室提供。
1.1.2 化学试剂
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒:北京索莱宝科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS):赛默飞世尔科技公司;TransStartR FastPfu DNA Polymerase:北京全式金生物技术股份有限公司;Agarose 琼脂糖凝胶配制试剂盒:上海万生昊天生物技术有限公司;AB-8大孔树脂:天津允开树脂科技有限公司;无水乙醇、丙酸、乙醚(均为分析纯)、CareTM亮蓝染料、琼脂、酵母粉(均为生化试剂):国药集团化学试剂有限公司;玉米粉、白砂糖、葡萄汁:市售。
1.1.3 培养基
基础培养基:称取白砂糖7.5 g、玉米粉10 g、酵母粉1 g、琼脂粉1 g,用100 mL纯水煮至无大颗粒,保持沸腾5 min,温度稍降后加入0.75 mL丙酸搅拌均匀,快速倒入培养瓶,121 ℃高压蒸汽灭菌15 min,密封,4 ℃保存备用。
高糖培养基:根据预实验结果采用半数致死浓度作为高糖浓度。白砂糖添加量为23.5 g,基础培养基中其余成分含量不变,121 ℃高压蒸汽灭菌15 min,密封,4 ℃保存备用。
含药培养基:在高糖培养基中分别加入1%、5%、10%枇杷叶提取物,制备1%、5%、10%含药培养基,121 ℃高压蒸汽灭菌15 min,密封,4 ℃保存备用。
收卵培养基:量取100 mL葡萄汁与200 mL纯水混合后加热至沸腾,温度稍降后加入0.75 mL丙酸搅拌均匀,快速倒入胚胎收集盘中,121 ℃高压蒸汽灭菌15 min,密封,4 ℃保存备用。
1.2 仪器与设备
XL-30C高速粉碎机:山东欧莱博科学仪器有限公司;CS101-ABN电热鼓风干燥箱:重庆康诚永生试验设备有限公司;GA-10RI实验室纯水机:郑州贯奥仪器仪表有限公司;ACS-KL-A电子天平:上海柯力称重设备有限公司;R-1001VN旋转蒸发仪:郑州长城科工贸有限公司;LRH-150低温生化培养箱:江苏迅迪仪器科技有限公司;ABI GeneAmpR 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪、E-Gel Power Snap 凝胶电泳系统:赛默飞世尔科技公司;全自动Auto2DR 双向电泳仪:默克化工技术(上海)有限公司。
1.3 实验方法
1.3.1 枇杷叶提取物的制备
选取无破损、无虫蛀的枇杷叶清洗干净,去除绒毛和粗叶脉,60 ℃干燥6 h后粉碎,过20目筛,得枇杷叶粉。
取适量枇杷叶粉,添加体积分数为75%的乙醇回流提取,45 ℃旋蒸浓缩至体积减半,得枇杷叶提取物原液。AB-8大孔树脂预处理后装柱,加入上述枇杷叶提取物原液上样,用体积分数50%的乙醇洗脱,流速2 mL/min。收集洗脱液,置于干燥箱中50 ℃干燥24 h,即得枇杷叶提取物,避光干燥储存,备用。
1.3.2 黑腹果蝇培养及分组
将基础培养基中培养的黑腹果蝇设置为对照组;将基础培养基上羽化24 h内的雌雄黑腹果蝇转入高糖培养基中培养出子一代黑腹果蝇,羽化后即为高糖黑腹果蝇,设置为高糖组;将高塘组存活黑腹果蝇转移至1%、5%、10%含药培养基培养出子一代黑腹果蝇,羽化后即为各浓度实验黑腹果蝇,分明命名为T+1%PP、T+5%PP、T+10%PP。各组黑腹果蝇分别在基础培养基、高糖培养基和各浓度含药培养基中培养,培养温度为25 ℃,相对湿度60%,光周期(光照∶黑暗)为12 h∶12 h,实验期间每3 d转移至相应的新鲜培养基。
1.3.3 黑腹果蝇生长发育能力检测
收集基础培养基中羽化24 h内的黑腹果蝇,分别转入新鲜基础培养基、高糖培养基和含药培养基(雌雄各10只,每组各3个重复),每天观察、记录黑腹果蝇死亡情况并及时更换新鲜培养基,记录黑腹果蝇的平均寿命、存活率,绘制生存曲线。
参考邓娟等[25]的方法并加以改进,统计基础培养基、高糖培养基和10%含药培养基中幼虫蛹化率、羽化率。
收集基础培养基、高糖培养基和10%含药培养基中培养的黑腹果蝇(雌雄各10只,每组各3个重复),低温麻醉后转移至透明玻璃管中进行攀爬能力检测。先让黑腹果蝇适应5 min,振动玻璃管使黑腹果蝇全部掉落至底部,保持玻璃管垂直、静置,记录10 s到达7 cm刻度线的达标黑腹果蝇数。各组黑腹果蝇的攀爬指数=达标黑腹果蝇数/总黑腹果蝇数×100%。
1.3.4 抗氧化能力检测
收集基础培养基、高糖培养基和10%含药培养基中10d、30 d、50 d的黑腹果蝇(雌雄各100只,每组各3个重复)低温麻醉并称质量,冷冻研磨制备黑腹果蝇匀浆,按试剂盒说明分别检测总蛋白(total protein,TP)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性和丙二醛(MDA)含量。
1.3.5 肠道完整性检测
收集基础培养基、高糖培养基和10%含药培养基中10d、30 d、50 d的黑腹果蝇(雌雄各20只,每组各3个重复)饥饿2 h,转入含Smurf染料溶液(2.5 g CareTM亮蓝溶于5%的葡萄糖溶液100 mL,过0.22 μm滤膜)的培养瓶,9~12 h后在解剖镜下观察,除口器和消化道外出现蓝色即判定为Smurf黑腹果蝇,以指征黑腹果蝇肠道破损情况。
1.3.6 肠道微生物16S rRNA测序与分析
收集普通培养基、高糖培养基和10%含药培养基中30 d的黑腹果蝇各200只(雌雄各100只,每组各3个重复),-20 ℃低温麻醉25 s,体积分数为75%乙醇和1×磷酸盐缓冲液(phosphate buffer solution,PBS)充分去除体表微生物后,加入PBS研磨,加入无菌甘油混匀,-80 ℃保存备用。普通培养基中收集的黑腹果蝇肠道样本命名为CK,随机分成三组,命名为CK-1、CK-2、CK-3;高糖培养基中收集的黑腹果蝇肠道样本命名为HG,随机分成三组,命名为HG-1、HG-2、HG-3;10%含药培养基中收集的黑腹果蝇肠道样本命名为LL,随机分成三组,命名为LL-1、LL-2、LL-3。黑腹果蝇肠道样本脱氧核糖核酸(deoxyribonucleic acid,DNA)提取、PCR扩增、测序及后续检测均由上海元莘生物医药科技有限公司进行。PCR扩增体系(25 μL):5×FastPfu Buffer 5 μL;2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)2.5 μL;5 μmol/L Forward Primer 1 μL;5 μmol/L Reverse Primer 1 μL;FastPfu DNA Polymerase 0.5 μL;牛血清白蛋白(bovine serum albumin,BSA)0.25 μL;Template DNA 10 ng;补双蒸水(ddH2O)至25 μL。PCR扩增条件:1×(95 ℃、3 min)→25×(95 ℃、30 s;55 ℃、30 s;72 ℃、45 s)→72 ℃、5 min,10 ℃直至结束。PCR扩增产物在1%琼脂糖凝胶上检测质量后并切胶回收,使用通用引物(上游引物:5'-ACTCCTACGGGAGGCAGCA-3',下游引物:5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因的V3-V4区进行两端测序(Illumina PE 250)。原始PE reads根据overlap关系拼接,经质控、过滤,区分样本后进行操作分类单位(operational taxonomic unit,OTU)聚类,对物种组成和多样性进行统计学和可视化分析。
1.3.7 数据处理
每组实验重复3次,使用Excel 2019进行原始数据的记录和整理,使用Graphpad Prism 10.0进行后续数据分析及作图;采用单因素方差分析进行多组间比较,采用最小显著差异(least significance difference,LSD)-t检验进行组内差异比较;统计结果以“平均值±标准差”表示,P<0.05 认为有显著性差异。
2 结果与分析
2.1 不同枇杷叶提取物添加量对黑腹果蝇生长发育的影响
不同物种具有不同的遗传背景,其寿命也存在较大差异,对于某一特定物种,影响寿命的主要变量是基因、环境。HUANG W等[26]鉴定出了1 008种对黑腹果蝇寿命有影响的基因,其中涉及神经发育、维护认知功能和运动能力的15个人类同源基因对寿命的影响都取决于具体的环境。对雌雄黑腹果蝇寿命、运动能力,黑腹果蝇幼虫的蛹化率、羽化率进行统计,结果见图1。由图1A和图1B可知,与对照比较,高糖饮食导致雌、雄黑腹果蝇的平均寿命高度显著缩短(P<0.000 1);添加1%的枇杷叶提取物对雌雄高糖黑腹果蝇的平均寿命均没有显著影响(P>0.05),添加5%的枇杷叶提取物能显著增加雌雄黑腹果蝇的平均寿命(P<0.05);添加10%的枇杷叶提取物能使高糖黑腹果蝇的平均寿命接近对照组黑腹果蝇。由图1C可知,各组黑腹果蝇寿命在性别上的差异不显著(P>0.05);由图1D和图1E可知,与对照组黑腹果蝇相比,高糖组黑腹果蝇的存活率降低,添加1%、5%、10%的枇杷叶提取物均能提高黑腹果蝇的存活率,但效果与浓度无明显对应关系。

图1 不同枇杷叶提取物添加量对黑腹果蝇寿命及存活率的影响
Fig.1 Effect of different loquat leaf extract addition on the lifespan and survival rates of Drosophila melanogaster
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“***”表示差异非常显著(P<0.001),“****”表示差异高度显著(P<0.000 1)。下同。
黑腹果蝇的生命周期包括卵、幼虫、蛹、成虫四个完全变态的发育阶段,主要受到保幼激素、蜕皮激素和协同调控[27],蛹化和羽化关系着黑腹果蝇能否顺利发育为成虫。不同枇杷叶提取物添加量对黑腹果蝇生殖和运动能力的影响结果见图2。由图2A可知,对照组黑腹果蝇蛹化率约为88.3%,高糖组蛹化率降至70.0%,说明高糖饮食能高度显著降低黑腹果蝇幼虫的蛹化率(P<0.000 1),添加1%、5%、10%的枇杷叶提取物时,黑腹果蝇蛹化率分别为78.3%、84.5%、89.2%,说明各添加量枇杷叶提取物都能在一定程度上提高蛹化率,其中添加5%、10%枇杷叶提取物影响效果极显著或高度显著(P<0.01或P<0.000 1)。由图2B可知,高糖饮食使黑腹果蝇蛹的羽化率从93.4%降至71.7%,添加1%、5%、10%的枇杷叶提取物时,黑腹果蝇蛹羽化率分别为73.3%、77.8%、90.5%,说明各添加量枇杷叶提取物都能在一定程度上提高羽化率,其中添加10%的枇杷叶提取物效果高度显著(P<0.000 1),但也不能恢复到正常水平。

图2 不同枇杷叶提取物添加量对黑腹果蝇生殖和运动能力的影响
Fig.2 Effect of different loquat leaf extract addition on reproductive and locomotor abilities of Drosophila melanogaster
黑腹果蝇在垂直空间内具有向上攀爬的特性,攀爬指数可以从行为学角度反映黑腹果蝇的运动性能。收集各培养基中10 d、30 d、50 d的黑腹果蝇分别代表青年、中年、老年黑腹果蝇进行攀爬实验,由图2C可知,随着年龄的增加,各组黑腹果蝇的运动能力极显著下降(P<0.01),以对照组为例,10 d、30 d、50 d时黑腹果蝇攀爬指数分别为95.9%、56.9%、31.0%。高糖组10 d、30 d、50 d时黑腹果蝇攀爬指数分别为85.7%、53.3%、23.3%,说明高糖饮食对各年龄段黑腹果蝇的运动能力都非常显著(P<0.001);通过给高糖黑腹果蝇喂养不同浓度的枇杷叶提取物,发现在饮食中添加1%的枇杷叶提取物不能影响高糖黑腹果蝇的运动能力,添加5%、10%的枇杷叶提取物能显著或高度显著提高黑腹果蝇的运动能力(P<0.05或P<0.0001)。研究发现[28],衰老会影响黑腹果蝇的细胞组成,衰老过程中肌肉细胞减少得最多。枇杷叶提取物提高黑腹果蝇运动能力可能与延缓肌肉细胞减少有关。
综上,高糖饮食降低了雌雄黑腹果蝇的平均寿命和存活率,也降低了黑腹果蝇幼虫的蛹化率和羽化率,也严重限制了黑腹果蝇的运动能力,在饮食中添加各浓度枇杷叶提取物均能在一定程度上缓解高糖饮食对黑腹果蝇生长发育指标的影响,
2.2 不同枇杷叶提取物添加量对黑腹果蝇抗氧化能力的影响
氧化应激加剧衰老进程,如剥夺睡眠能造成黑腹果蝇肠道活性氧的大规模累积,引发严重的氧化应激,加剧黑腹果蝇的衰老[29];红芪多糖、蜂王浆等活性物质则通过上调抗氧化酶活性来抵御内源氧化应激以促进黑腹果蝇长寿[30-31]。抗氧化酶广泛分布于生物体内,超氧化物歧化酶(SOD)可以催化超氧阴离子自由基歧化生成过氧化氢和氧,过氧化氢酶(CAT)则将过氧化氢分解为水和氧气,二者相互作用,通过清除机体过多的自由基来提升抗氧化水平;MDA是脂质过氧化的最终分解产物,能反映机体脂质氧化损伤程度。
为了探讨枇杷叶提取物对高糖黑腹果蝇氧化损伤的修复作用,在前述生长发育指标检测的基础上,选用10%枇杷叶提取物喂养各组黑腹果蝇,分别对对照组、高糖组、10%枇杷叶添加组(T+10%PP)雌雄黑腹果蝇样本进行超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性及丙二醛(MDA)的含量进行检测,结果见图3。由图3A、图3B可知,对照组雌雄黑腹果蝇的SOD活性分别为91.8 U/mg、78.8 U/mg,CAT活性分别为11.3 U/mg、11.3 U/mg,而高糖组雌雄黑腹果蝇的SOD活性分别降至82.9 U/mg、69.7 U/mg,CAT活性分别降至8.5 U/mg、8.5 U/mg,添加10%的枇杷叶提取物非常显著提高了雌雄黑腹果蝇体内SOD、CAT活性(P<0.001);由图3C可知,高糖饮食导致黑腹果蝇脂质氧化损伤加剧,黑腹果蝇体内MDA含量显著上升,通过补充10%的枇杷叶提取物可以非常显著降低MDA含量(P<0.001)。
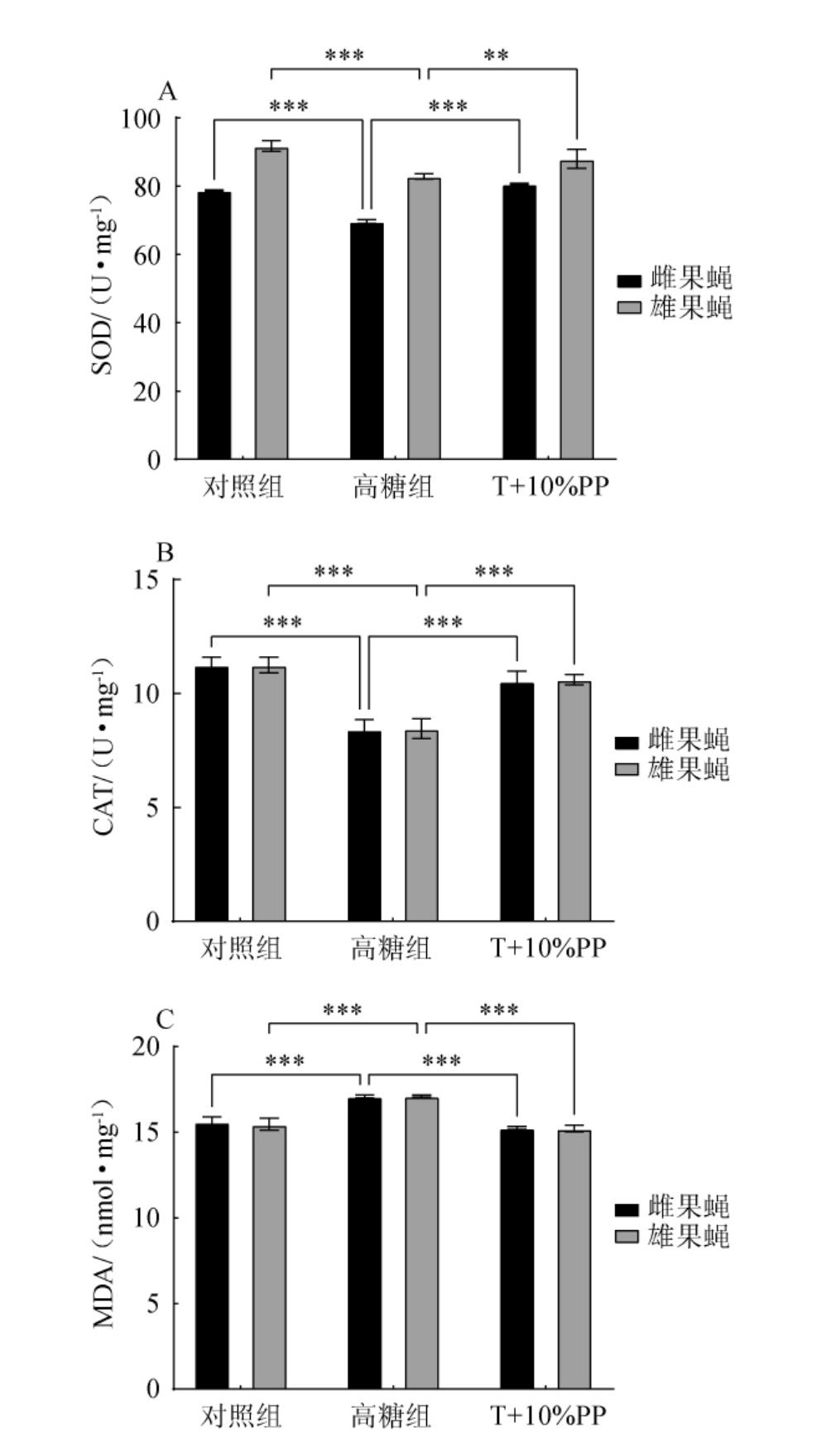
图3 添加10%枇杷叶提取物对高糖组黑腹果蝇抗氧化能力的影响
Fig.3 Effect of loquat leaf extract addition 10% on antioxidant capacity of Drosophila melanogaster in high sugar group
综上,高糖饮食加剧了雌雄黑腹果蝇的氧化损伤,10%的枇杷叶提取物通过提高抗氧化酶SOD、CAT的活性来清除自由基,提高黑腹果蝇的抗氧化能力,减少脂质氧化损伤。
2.3 黑腹果蝇肠道完整性
黑腹果蝇的消化道与哺乳动物有着非常类似的结构,肠道的完整性能有效抵御外部环境的感染。当暴露在不良环境时,黑腹果蝇中肠干细胞通过快速增殖分化来维持肠道稳态。高糖饮食导致黑腹果蝇代谢紊乱,肠道稳态失衡,屏障被破坏,喂食亮蓝染料后,染料会弥散到整个腹部(图4A,右),记为蓝精灵(Smurf),正常黑腹果蝇仅肠道着色(图4B,左)。由图4B和图4C可知,随着年龄的增长,雌雄黑腹果蝇出现Smurf比例增加,说明正常衰老时,黑腹果蝇肠道也会逐渐积累损伤;高糖饮食对青年黑腹果蝇的肠道破坏作用不明显,但能影响中年及老年黑腹果蝇的肠道完整性,造成Smurf 比例增加;添加10%枇杷叶提取物能使30 d的高糖组雌黑腹果蝇出现Smurf的比例从65.6%降至48.8%(P<0.01),使50 d的高糖组雌黑腹果蝇出现Smurf的比例从82.3%降至80.7%(P<0.05),说明10%的枇杷叶提取物能极显著或显著缓解中年及老年黑腹果蝇的肠道损伤;值得关注的是,高糖饮食的损伤作用和10%枇杷叶提取物的矫正作用在中年组黑腹果蝇中表现得都更为显著,说明高糖饮食造成肠道损伤与黑腹果蝇所处年龄阶段息息相关,年轻黑腹果蝇自我调节能力更强,中年黑腹果蝇更容易受饮食关键影响,另一方面也说明正常衰老的黑腹果蝇也积累了较多的肠道损伤,枇杷叶提取物的缓解作用未能较好体现。
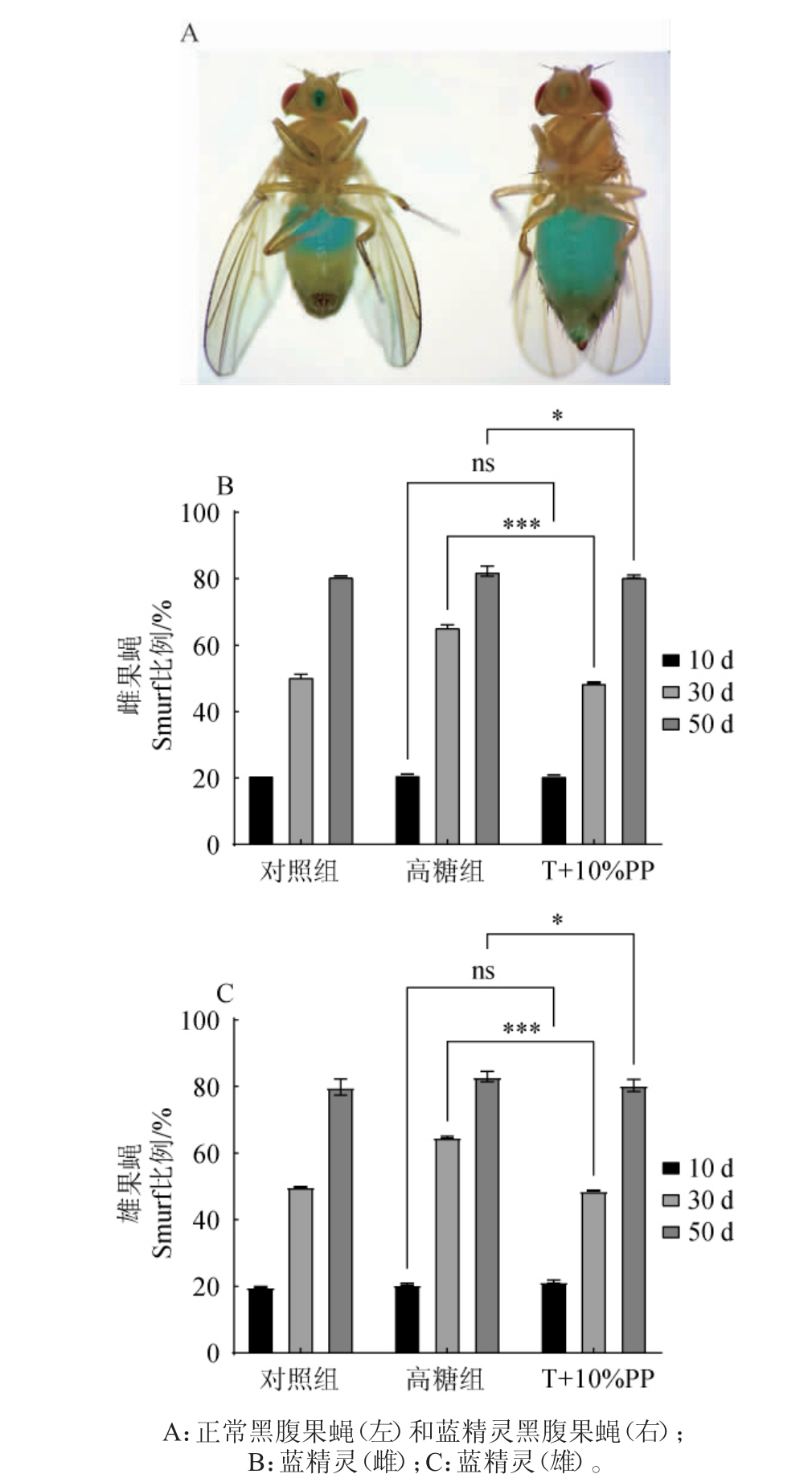
图4 添加10%枇杷叶提取物对高糖组黑腹果蝇肠损伤的影响
Fig.4 Effect of loquat leaf extract addition 10% on intestinal damage in Drosophila melanogaster in high sugar group
2.4 黑腹果蝇肠道微生物16S rRNA检测结果
2.4.1 测序质量评价
由图5A可知,对9个样本测序并优化共得到498 418条优化序列,优化数据碱基数为204 350 473 bp,序列平均长度为410.00 bp。经过97%相似度归并,3 组9 个样本共得到281个OTU,其中各组共有OTU 数70 个,CK组独有OTU数23个,HG组独有OTU数31个,LL组独有OTU数76个。采用对序列进行随机抽样的方法,以抽到的序列数与它们所能代表OTU的数目构建稀释性曲线(rarefaction-curve),如图5B所示,各组曲线趋向平坦,coverage 指数均>0.99,说明测序数据量较为合理,继续测序也不能产生更多的OTU,测序结果能代表样本中微生物的真实情况。
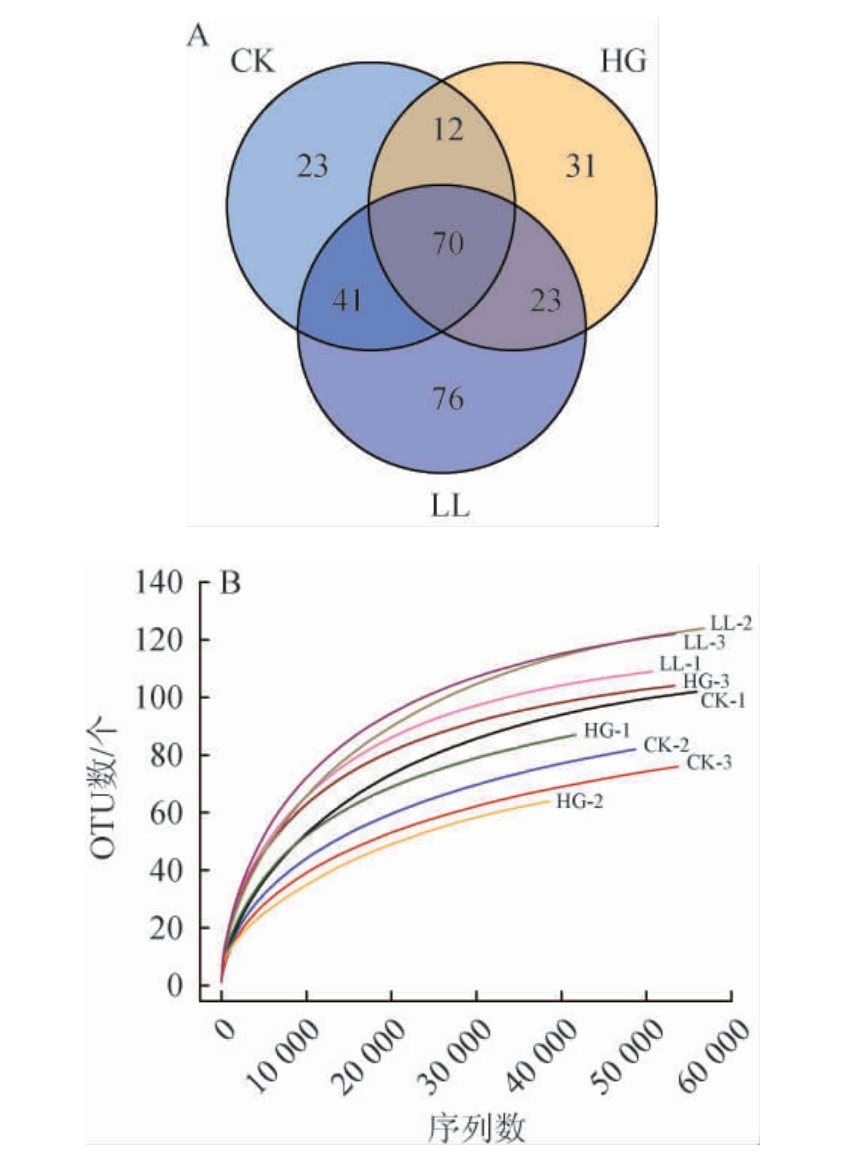
图5 黑腹果蝇肠道菌群操作分类单元韦恩图(A)和稀释性曲线(B)
Fig.5 Operational taxonomic unit Venn diagram (A) and dilution curves (B) of intestinal flora in Drosophila melanogaster
2.4.2 样本Alpha多样性分析
对单个样本的多样性(α多样性)进行分析,通过Chao指数和ACE指数计算菌群丰富度,通过Shannon指数和Simpson指数计算菌群多样性;分别对各个指数进行参数检验(R语言,Anova函数),筛选不同条件下的显著差异的α多样性指数。α指数参数检验分面箱线图见图6。由图6可知,三组样本中,HG组和CK组差异不大,说明高糖饮食对菌群丰富度影响不大;LL组的Ace与Chao1指数要极显著高于CK组和HG组(P<0.01),说明枇杷叶提取物能显著上调高糖饮食黑腹果蝇的菌群丰富度。Shannon指数综合考虑群落的丰富度和均匀度,HG组的Shannon指数显著高于CK组(P<0.05),说明高糖饮食能引起黑腹果蝇肠道菌群紊乱,菌群组成发生变化,菌群多样性显著增加;添加10%的枇杷叶提取物并不能使菌群结构恢复到原有水平(P>0.05);Simpson指数容易受到物种均匀度的影响,Simpson指数值越大,说明群落内不同种类微生物数量分布越不均匀,优势微生物的生态功能越突出;本实验中枇杷叶提取物喂养的黑腹果蝇相较其他组群落微生物分布更为均匀,但差异不显著(P>0.05);综合各指数信息和各组样本独有OTU信息可知,高糖饮食改变黑腹果蝇的肠道菌群组成,使添加10%枇杷叶提取物的培养基能显著增加菌群丰富度,也可以在一定程度上改善菌群均匀度。
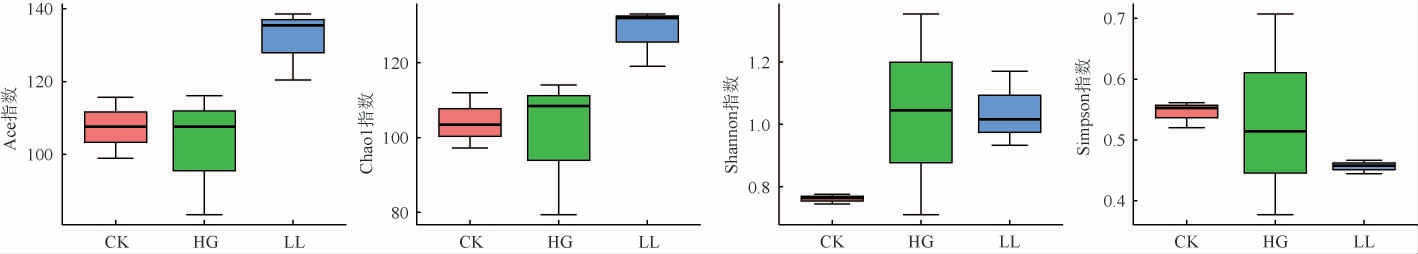
图6 黑腹果蝇肠道菌群Alpha多样性指数箱图
Fig.6 Box plots of Alpha diversity indexes of Drosophila intestinal flora
以OTU等级为横坐标,以该等级OTU种序列数的相对百分含量为纵坐标构建丰度等级曲线(Rank-abundance)。由图7可知,在水平方向上,LL组各样本物种丰富度略高,在横轴上的范围略大,曲线也较平缓,说明物种分布也较为均匀。
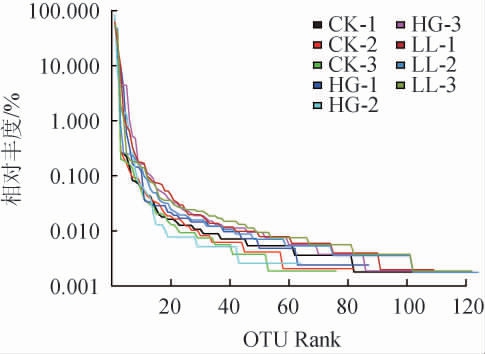
图7 黑腹果蝇肠道菌群Alpha多样性指数等级曲线
Fig.7 Rank curves of Alpha diversity indexes of Drosophila intestinal flora
2.4.3 物种组成分析
根据OTU注释结果分别在门、纲、目、科、种、属分类水平统计CK组、HG组、LL组各样品的物种相对丰度,结果见图8。由图8可知,CK组菌群共有10个门,14个纲、44个目、79个科、116个属、133个种,HG组菌群共有9个门、16个纲、42个目、69个科、103个属、127个种,LL组菌群共有13个门、24个纲、59个目、107个科、155个属、191个属,其中CK独有一个菌门为螺旋体菌门(Spirochaetota)。在门水平,各组黑腹果蝇肠道样本的优势菌门为变形菌门(Proteobacteria)(CK组:99.1%;HG组:98.3%;LL组:98.5%);在纲水平,CK组和LL组以α-变形菌纲(Alphaproteobacteria),HG组则以γ-变形菌纲(Gammaproteobacteria)为主;γ-变形菌纲是最多样化的革兰氏阴性细菌,包含了许多病原体,多数与炎症反应有重要关联。在目水平,CK组和LL组以立克次氏体(Rickettsiales)、醋杆菌(Acetobacterales)为主,HG组的肠杆菌(Enterobacterales)含量则远超其他两种,为优势属。
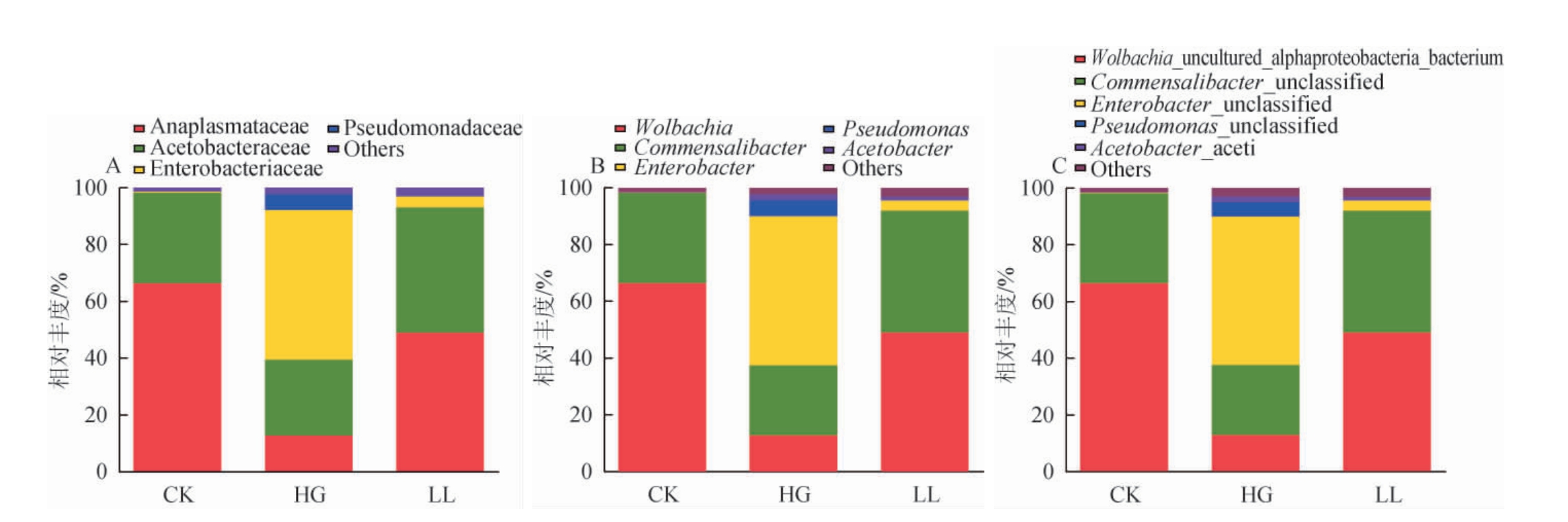
图8 黑腹果蝇肠道菌群在科(A)、属(B)、种(C)水平的相对丰度
Fig.8 Relative abundance of intestinal flora at family(A), genus (B), species(C) levels in Drosophila melanogaster
由图8A可知,在科水平上,鉴定到CK组、LL组的优势菌群伟立克次氏体目科无浆体科(Anaplasmataceae)(CK组:66.4%;LL组:49%;HG组:12.8%)和醋杆菌科(Acetobacteraceae)(CK组:31.8%;LL组:44.1%;HG组:26.7%),HG的优势菌科肠杆菌科(Enterobacteriaceae)(CK组:0.3%;LL组:3.83%;HG组:52.6%)。由图8B可知,在属水平上,鉴定到CK、LL组的优势菌属为沃尔巴克氏菌属(Wolbachia)(CK组:66.4%;LL组:49%;HG组:12.8%)和肠共生杆菌属(Commensalibacter)(CK:31.7%;LL组:42.9%;HG:24.6%),HG的优势菌属为肠杆菌属(Enterobacter)(CK:0.17%;LL组:3.66%;HG组:52.5%)。由图8C可知,在种水平上,鉴定到CK组、LL组的优势菌种为沃尔巴克氏菌(Wolbachia)(CK组:66.4%;LL组:49%;HG组:12.8%)和共生杆菌(Commensalibacter)(CK组:31.7%;LL组:42.9%;HG组:24.7%),HG组的优势菌种为肠杆菌(Enterobacter)(CK组:0.17%;LL组:3.67%;HG组:52.5%)。
结果显示,各组样本微生物在门水平差异不大,优势菌门均为变形菌门;从纲水平开始,HG 组的菌群结构发生了较大的变化,与CK组相比,其优势菌从α-变形菌纲转变为γ-变形菌纲,在目、科、属、种水平的优势菌均为肠杆菌;添加10%枇杷叶提取物能使各分类层级的优势菌恢复主导地位,矫正后的菌群结构接近CK组。结果表明,高糖饮食可以通过改变黑腹果蝇肠道菌群结构来造成黑腹果蝇的氧化损伤,添加10%枇杷叶提取物可以重建黑腹果蝇肠道菌群,从而达到在一定程度上修复氧化损伤的作用。
将不同丰度的物种分块聚集,通过颜色梯度和相似程度来反映多个样本在种水平群落组成的相似性和差异性,越红代表相对丰度越高,越蓝表示相对丰度越低。基于属水平黑腹果蝇肠道菌群组成聚类分析热图见图9。由图9可知,相对丰度排名在前50的菌种,分析发现,CK组和LL组相对丰度较高的有沃尔巴西亚菌(Wolbachia)、康门氏杆菌(Commensalibacter),而HG组这两种菌丰度较低;肠杆菌(Enterobacter)在HG组丰度较高,在CK组和LL组丰度较低。HG-3和LL-1两个样本在聚类时与同组其他样本略有差异,推测是黑腹果蝇肠道菌群结构相对简单,易受环境影响的原因,也不排除样本采集或测序过程中存在问题,后续通过增加样本量进一步分析。
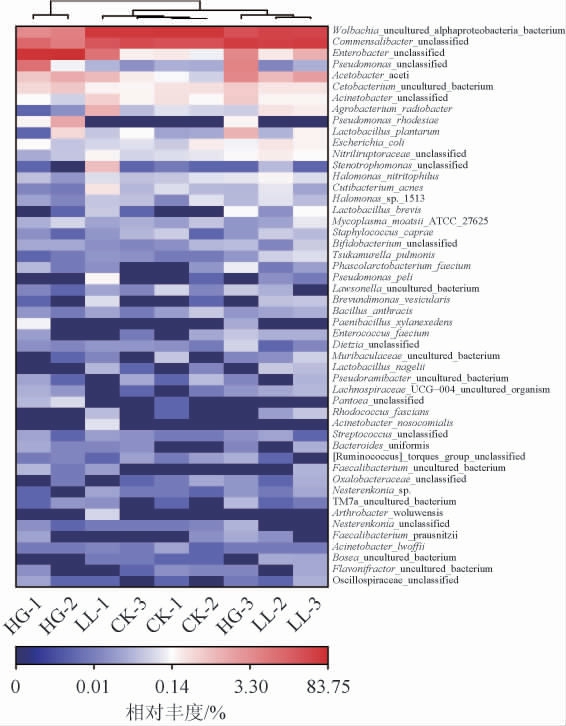
图9 基于属水平黑腹果蝇肠道菌群组成聚类分析热图
Fig.9 Heat map of intestinal flora composition in Drosophila melanogaster at genus level
2.4.4 样本β多样性分析
对不同样本的菌群构成进行主坐标分析(principal co-ordinates analysis,PCoA),对各组数据的相似性和差异性进行可视化(R语言)分析,结果见图10。由图10可知,不同的颜色和形状标识分别代表不同样本,横纵坐标轴刻度无实际意义。第一主坐标(PCo1)的方差贡献率为88.66%,表示横坐标的差异可以解释全面分析结果的88.66%,第二主坐标(PCo2)的方差贡献率为10.62%,二者累计方差贡献率接近100%,可以准确地反映样本的差异性。HG组的两个样本在PCo1轴方向上与CK组和LL组分离开来,可分析为PCo1是导致HG与其他两组分开的主要因素,CK组与LL的两个样本在PCo2水平上分离开来,说明PCo2是导致二者分开的主要因素。综合来看,高糖饮食造成黑腹果蝇肠道菌群结构发生显著的变化(P=0.022<0.05),经10%PP的枇杷叶提取物校正后,黑腹果蝇肠道微生物群落构成有所修复,但与对照组仍有差距。
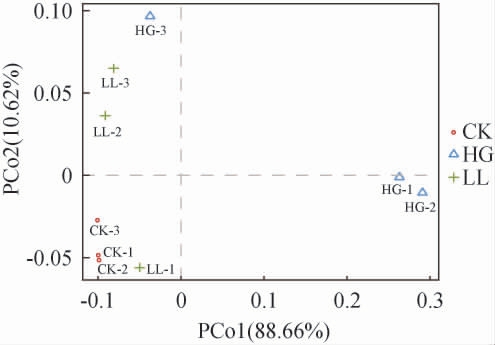
图10 黑腹果蝇肠道菌群主坐标分析
Fig.10 Principal coordinates analysis of intestinal flora in Drosophila melanogaster
2.4.5 肠道样本线性判别分析
使用非参数因子Kruskal-Wallis 秩和检验(non-parametric factorial Kruskal-Wallis sum-rank test)获得显著性差异物种,通过Wilcoxon秩和检验(WilcoxonSignedRankTest)检测前述显著性差异物种的所有亚种是否趋于同一分类级别,再采用线性判别分析向量大小(linear discriminant analysis effect size,LEfSe)检测不同分组间具有统计学差异的生物标记物(biomarkers)。筛选3组黑腹果蝇肠道中具有统计学差异的微生物,得到多级物种柱状图,结果见图11。

图11 黑腹果蝇肠道菌群线性判别分析效应值大小
Fig.11 Linear discriminant analysis effect size of intestinal flora in Drosophila melanogaster
由图11可知,柱状图颜色代表组别,长短代表LDA值,将LDA 设为2,共有23个不同分类水平的差异菌群可以作为各组生物标记物,其中CK组有5个,HG组有8个,LL组有10个。在属水平,CK组具有统计学差异的属为沃尔巴克氏菌属(Wolbachia);LL组中具有统计学差异的属为甲基球状菌属(Methylopila)、博斯氏菌属(Bosea)、甘草乳杆菌属(Liquorilactobacillus)、红球菌属(Rhodococcus);HG组具有统计学差异的属有β-变形菌纲的劳特罗普氏菌属(Lautropia)、γ-变形菌纲的肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)。机体在免疫功能低下时易感染肠杆菌属菌群,部分菌株产生的毒素会穿透肠细胞的细胞膜,导致肠部炎症和破损;假单胞菌属菌群具有较强的代谢能力和较大的适应环境潜力,因此常引起肠道、呼吸道的感染和疾病。HG组的以上菌群可能是导致黑腹果蝇肠道损伤和菌群结构破坏的主要原因。LL组中各致病菌丰度相对较低,在一定程度上表现为黑腹果蝇肠道菌群的修复和矫正,但LL组具有标记性的甲基球状菌属(Methylopila)、博斯氏菌属(Bosea)、甘草乳杆菌属(Liquorilactobacillus)、红球菌属(Rhodococcus)在CK组和HG组在未被统计,说明各组优势菌种差异较大,LL组特征菌群的潜在修复作用有待进一步研究。
3 讨论
高糖饮食能加速代谢紊乱的进展,导致多种代谢疾病、心血管疾病和癌症的发病风险增加[33-35]。在倡导饮食结构调整的同时,学者们也在积极探寻新的破局之道。赵善廷等[36]研究发现,植物提取物杜仲多糖通过降低肠道ROS生成相关菌群的丰度来可以延长黑腹果蝇寿命、促进老年黑腹果蝇的运动活性和繁殖力、减少老年黑腹果蝇的氧化应激;李秀娟等[37-38]研究显示,元宝枫油和人参-熟地黄水提物也有类似的作用。
4 结论
实验以黑腹果蝇为研究对象探讨了枇杷叶提取物对高糖饮食造成的代谢紊乱的缓解作用,结果显示,高糖饮食限制了黑腹果蝇的变态发育,通过加剧氧化损伤的方式影响了黑腹果蝇的运动能力和寿命;高糖饮食能导致黑腹果蝇肠道损伤,造成肠道菌群紊乱;添加量为10%的枇杷叶提取物可以显著提高黑腹果蝇幼虫的蛹化率、羽化率,提高老年黑腹果蝇的运动能力和抗氧化能力,并通过维护肠道屏障、调整肠道菌群组成的方式改善肠道功能,在一定程度上缓解了高糖饮食造成的黑腹果蝇代谢紊乱。
[1]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2020:213-214.
[2]郭英杰.双相低共熔溶剂体系同步提取枇杷叶多糖和三萜酸及其分离纯化方法研究[D].杨凌:西北农林科技大学,2023.
[3]郭松斌,杨韧强,柯文林.不同形态多酚枇杷叶提取物活性及其应用研究[J].食品工业,2021,42(10):98-103.
[4]黄露.低共熔溶剂提取枇杷叶三萜酸研究[D].杨凌:西北农林科技大学,2023.
[5]王增斌.枇杷叶主要成分周年变化规律研究[D].杨凌:西北农林科技大学,2022.
[6]肖旭坤,王翰华,阮洪生.枇杷叶化学成分和药理活性研究进展[J].中医药导报,2019,25(21):60-66.
[7]宋宁,刘语,刘铮铮,等.GC-MS方法分析新鲜枇杷叶挥发油及β-葡萄糖苷酶对枇杷叶的增香作用[J].中国林副特产,2019(6):5-7,12.
[8]徐兴阳.蒙药三红汤中单味药(茜草、枇杷叶)的化学成分研究[D].通辽:内蒙古民族大学,2022.
[9]陈剑,赵磊,黄晓杰,等.枇杷叶6种三萜酸的人肠道菌群生物转化及其抑制α-葡萄糖苷酶活性研究[J].时珍国医国药,2022,33(2):270-272.
[10]MOGOLE L,OMWOYO W,MTUNZI F.Phytochemical screening,antioxidant activity and α-amylase inhibition study using different extracts of loquat(Eriobotrya japonica)leaves[J].Heliyon,2020,6(8):e04736.
[11]雒江菡,高原,王福玲,等.枇杷叶多糖的提取及抑菌活性研究[J].黑龙江医药,2023,36(6):1241-1244.
[12]KIM T, PAUDEL K R, KIM D W.Eriobotrya japonica leaf extract attenuates airway inflammation in ovalbumin-induced mice model of asthma[J].J Ethnopharmacol,2020,253:112082.
[13]幸晓清,赵杨,司风玲.枇杷叶提取物对冷却肉的保鲜效果[J].食品与发酵工业,2022,48(7):219-225.
[14]JIAN T,CHEN J,DING X,et al.Flavonoids isolated from loquat (Eriobotrya japonica) leaves inhibit oxidative stress and inflammation induced by cigarette smoke in COPD mice: the role of TRPV1 signaling pathways[J].Food Funct,2020,11(4):3516-3526.
[15]JIAN T Y,DING X Q,LI J W,et al.Triterpene acids of loquat leaf improve inflammation in cigarette smoking induced COPD by regulating AMPK/Nrf2 and NFκB pathways[J].Nutrients,2020,12(3):657-671.
[16] HUANG Y, CHEN Z, CHEN B, et al.Dietary sugar consumption and health:umbrella review[J].BMJ,2023,381:e071609.
[17]LI M,MACRO J,MEADOWS K,et al.Late-life shift in caloric intake affects fly metabolism and longevity[J].P Natl Acad Sci USA,2023,120(50):e2311019120.
[18]ZHANG L,SUN H,LIU Z,et al.Association between dietary sugar intake and depression in US adults:a cross-sectional study using data from the National Health and Nutrition Examination Survey 2011-2018[J].BMC Psychiatry,2024,24(1):110.
[19]中国炎症性肠病生物制剂治疗专家建议(试行)[J].中华消化病与影像杂志(电子版),2021,11(6):244-256.
[20]HOCHREIN S M,WU H,ECKSTEIN M,et al.The glucose transporter GLUT3 controls T helper 17 cell responses through glycolytic-epigenetic reprogramming[J].Cell Metab,2022,34(4):516-532.
[21]LAFFIN M,FEDORAK R,ZALASKY A,et al.A high-sugar diet rapidly enhances susceptibility to colitis via depletion of luminal short-chain fatty acids in mice[J].Sci Rep,2019,9(1):12294-12312.
[22]杜艳娇,田瑶,袁志霄.黑腹果蝇肠道共生菌对宿主作用的研究进展[J].微生物学报,2021,61(7):1896-1909.
[23]MIGUEL-ALIAGA I,JASPER H,LEMAITRE B.Anatomy and physiology of the digestive tract of Drosophila melanogaster[J].Genetics,2018,210(2):357-396.
[24]IATSENKO I,BOQUETE J P,LEMAITRE B.Microbiota-derived lactate activates production of reactive oxygen species by the intestinal NADPH oxidase Nox and shortens Drosophila lifespan[J].Immunity,2018,49(5):929-942.
[25]邓娟,刘南.不同发育时期黑腹果蝇样品的收集[J].Bio-Protocol,2019.
[26]HUANG W,CAMPBELL T,CARBONE M A,et al.Context-dependent genetic architecture of Drosophila life span[J].Plos Biol, 2020, 18(3):e3000645.
[27]YANG Y, ZHAO T, LI Z, et al.Histone H3K27 methylation-mediated repression of hairy regulates insect developmental transition by modulating ecdysone biosynthesis[J].P Natl Acad Sci USA,2021,118(35):e2101442118.
[28]LU T C,BRBIC′ M,PARK Y J,et al.Aging fly cell atlas identifies exhaustive aging features at cellular resolution[J].Science, 2023, 380(6650):eadg0934.
[29]VACCARO A,DOR Y K,NAMBARA K,et al.Sleep loss can cause death through accumulation of reactive oxygen species in the gut[J].Cell,2020,181(6):1307-1328.
[30]YANG S, XIU M, LI X, et al.The antioxidant effects of Hedysarum polybotrys polysaccharide in extending lifespan and ameliorating agingrelated diseases in Drosophila melanogaster[J].Int J Biol Macromol,2023,241:124609.
[31]WEN D J,XIE J Y,YUAN Y,et al.The endogenous antioxidant ability of royal jelly in Drosophila is independent of Keap1/Nrf2 by activating oxidoreductase activity[J].Insect Sci,2023,31(2):503-523.
[32]HOCHREIN S M,WU H,ECKSTEIN M,et al.The glucose transporter GLUT3 controls T helper 17 cell responses through glycolytic-epigenetic reprogramming[J].Cell Metab,2022,34(4):516-532.
[33]李蓉,徐艳,缪园欣,等.基于转录组学探究高糖饮食诱导秀丽线虫衰老的分子机制[J].食品科学,2024,45(11):24-30.
[34]ZHOU P, CHANG W Y, GONG D A, et al.High dietary fructose promotes hepatocellular carcinoma progression by enhancing O-GlcNAcylation via microbiota-derived acetate[J].Cell Metab,2023,35(11):1961-1975.
[35]LIN X, LEI Y, PAN M.Augmentation of scleral glycolysis promotes myopia through histone lactylation[J].Cell Metab,2024,36(3):511-525.
[36]WEI JJ,LI XJ,LIU W.Eucommia polysaccharides ameliorate aging-associated gut dysbiosis: A potential mechanism for life extension in Drosophila[J].Int J Mol Sci,2023,24(6):5881.
[37]李秀娟,魏晶晶,柴学军.元宝枫油对衰老黑腹果蝇生理指标及肠道菌群的影响[J].食品科学,2024,45(3):76-83.
[38]曾雪元,赵为民,王思明.人参-熟地黄水提物对雄性黑腹果蝇的抗衰老作用及其机制[J].吉林中医药,2023,43(11):1336-1341.