白酒酿造在我国具有悠久的历史,主要是指各种富含淀粉质的谷物经微生物发酵,产生独特色泽、口感、香气的含酒精饮品的技术[1]。目前酿酒通常在高温、高糖、低pH、高乙醇浓度等高胁迫环境中进行,生产菌良好的环境耐受性是其在发酵环境发挥作用的重要保障[2-3]。白酒生产中常以外加酶、加酸、加热等方式进行原料的糊化、液化,以便发酵菌快速利用底物中的淀粉等营养物质[4],这些步骤不仅对操作人员有较高要求还会增加生产投入成本,会在一定程度上降低该行业的发展速度[3]。故从生产用菌角度出发,将酶系丰富、酶活高、可用于生料发酵且环境耐受性好的菌株应用于生产是解决以上问题的低成本且有效的方式之一。
扣囊复膜酵母(Saccharomycopsis fibuligera)存在于各种高淀粉质基质中,如各种大曲、酒醅等,是多种酿造曲中的优势微生物[5-6]。其可分泌丰富酶系,如淀粉酶、β-葡萄糖苷酶、蛋白酶等,在发酵时可有效水解底物中的淀粉、蛋白、纤维素等物质,有助于提高原料利用率[7-8]。如周阳子等[9]从高温大曲中筛选出一株产淀粉酶活达1 452 U/mL的扣囊复膜酵母菌株可用于强化大曲,增加淀粉利用率,提高白酒品质;MACHIDA M等[8]研究表明,扣囊复膜酵母与酿酒酵母协同作用,可解决酿酒酵母对纤维素原料利用率不高的问题,从而提高乙醇产量;SU C等[10]研究发现,与传统发酵剂相比,将扣囊复膜和酿酒酵母复配进行小曲酒发酵可提高了葡萄糖淀酶和酸性蛋白酶活性,乙醇和酯的含量分别提高了42.5%和11.8%。扣囊复膜酵母还可发酵产生多种酯类、内酯类、醇类、有机酸类和醛酮类等风味物质,可给产品带来良好的风味体验[9,11-13]。王晓丹等[14]从酱香型白酒大曲中分离到一株扣囊复膜酵母FBKL2.0071,由其发酵的固态发酵物具浓郁果香味,其中乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、棕榈酸乙酯、苯乙醇等具花果香的香气物质的含量较高;马美荣等[11]研究表明,扣囊复膜酵母发酵的麸曲含有乙缩醛、戊酸乙酯和乙酸等清香型白酒中重要的风味物质,试验酒样中作为主体香味物质的乙酸乙酯含量比对照提高了14.40%。且有研究表明,扣囊复膜酵母菌株可作为啤酒、清香型麸曲白酒、米酒、红枣酒等多种酒产品工业生产的新菌种选择[11-13,15]。综上,将扣囊复膜酵母应用于发酵食品将有助于营养物质以及风味物质的形成,在发酵领域具有重要应用价值与潜力。
故本研究以开发选育环境耐受性高、底物来源广、产酶产香能力优异的菌株为目的,从老米酒样品中分离筛选到一株高产淀粉酶的菌株,并对其环境耐受、底物利用、产酶特性、生料发酵产乙醇产香等酿造性能方面进行了研究,以期为酿造业提供优良菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
老米酒:孝感农户家自制,由本实验室采集,并于4 ℃保存。玉米淀粉:山东嘉景化工有限公司;麸皮:灵寿县信德农产品有限公司
1.1.2 化学试剂
酵母浸粉、蛋白胨(均为生化试剂)、蔗糖:安琪酵母股份有限公司;木糖、半乳糖、麦芽糖、纤维二糖(均为生化试剂),海藻糖、阿拉伯糖、蜜二糖、棉子糖(纯度均为99%),葡萄糖、可溶性淀粉、七水硫酸镁、硫酸铵、磷酸氢二钠、磷酸二氢钠、硼酸钠、乳酸钠、乙酸钠(均为分析纯):国药集团化学试剂有限公司;无氨基酵母氮源(yeast nitrogen base without amino acids,YNB):北京索莱宝科技有限公司;琼脂(生化试剂):上海惠兴生化试剂有限公司;无水乙醇(分析纯):郑州派尼化学试剂厂;乳糖、松三糖(纯度均为99%),磷酸氢二钾(分析纯):上海源叶生物科技有限公司;硫酸、氢氧化钠、乳酸、盐酸、乙酸(均为分析纯):西陇科学股份有限公司;滤纸:杭州特种纸业有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
酵母浸出粉葡萄糖(yeastextractpeptonedextrose,YPD)液体培养基(种子液培养基):酵母浸粉10 g、葡萄糖20 g、蛋白胨20 g、水1 000 mL,115 ℃灭菌20 min;固体培养基添加琼脂20 g。
淀粉酶筛选培养基:2%可溶性淀粉、1%酵母浸粉、2%蛋白胨、2%琼脂,121 ℃灭菌20 min。
碳源同化培养基:0.67 g YNB、2 g碳源(葡萄糖、木糖、阿拉伯糖、半乳糖、乳糖、麦芽糖、蜜二糖、蔗糖、海藻糖、纤维二糖、松三糖、棉子糖、可溶性淀粉、生玉米淀粉),水100 mL,过滤除菌。
麸曲固态发酵培养基:麸皮20 g、磷酸二氢钾0.06 g、七水硫酸镁0.02 g、硫酸铵0.92 g、水10 mL,115 ℃灭菌20 min。
生玉米淀粉液态发酵培养基:玉米淀粉50 g、尿素0.5 g、七水硫酸镁0.4 g、1.5%稀硫酸0.1 mL、水100 mL,紫外灭菌2 h、105 ℃干热灭菌2 h。
1.2 仪器与设备
ZWYR-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;SPX-II300生化培养箱:上海跃进医疗器械有限公司;UVP-97-0065-08凝胶成像系统:美国Bio-Rad公司;DYY-6C电泳仪:北京六一生物科技有限公司;PTC-100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国MJ Research公司;700201000真空冷冻干燥机:美国Labconco公司;DL-5200B-II离心机:上海安亭科学仪器厂;7890A气相色谱仪(gas chromatography,GC):美国安捷伦科技有限公司;LC-40DXR高效液相色谱仪:日本岛津公司;SkyHigh酶标仪:美国赛默飞公司。
1.3 方法
1.3.1 高产淀粉酶菌株分离纯化
将1 g老米酒样品溶于100 mL无菌水中混匀,以10倍梯度稀释至10-5、10-6,吸取100 μL稀释样品涂布于淀粉酶筛选培养基,30℃培养24h后加入卢戈氏碘液,显色后挑取有水解圈的单菌落,划线纯化,接种于YPD斜面培养基,4 ℃保存。
1.3.2 形态学特征鉴定
将挑选的菌株划线接种于YPD固体培养基,30 ℃静置培养24 h后观察菌落形态;挑取单菌落接种于5 mL YPD液体培养基中,30 ℃、180r/min培养24 h制备种子液,吸取10μL种子液于载玻片,在光学显微镜下放大400倍观察菌体形态。
1.3.3 菌株的分子生物学鉴定
根据参考文献[9]的方法使用酵母基因组DNA提取试剂盒提取菌株基因组,以内部转录间隔区1(internal transcribed spacer1,ITS1)(5'-TCCGTAGGTGAACCTGCGG-3'),ITS4(5'-TCCTCCGCTTATTGATATGC-3')为引物,PCR扩增程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,30个循环;最后72 ℃延伸10 min,经1%凝胶电泳检测及测序后,将测序结果在美国国立生物技术信息中心(national venter for biotechnology information,NCBI)库中使用基本局部比对搜索工具(basic local comparison search tool,BLAST)分析比对,用MEGA 5.0软件中邻接(neighborjoining,NJ)法进行系统进化树分析[16]。
1.3.4 菌株耐受能力测定
将种子液12 000 r/min离心5 min后去上清,用等体积灭菌纯水重悬,然后再次离心去上清,再加入同体积灭菌纯水,洗去原培养基,制备重悬种子液。
将重悬种子液按1%的接种量接种至装有200 μL YPD培养基的96孔培养板中,每一处理接3孔,另设1孔作为无菌空白对照,30 ℃、180 r/min条件下培养48 h后测定OD600nm,以OD600nm净增长值达0.1视为生长。
参考王志男等[17]的方法并进行适当修改。耐温试验设置培养温度分别为30 ℃、37 ℃、40 ℃、42 ℃;耐低pH试验设置YPD培养基pH分别为4.0、3.5、3.0、2.5;耐乙醇试验设置YPD培养基乙醇含量分别为6%、8%、10%、12%(V/V)。耐高糖试验设置YPD培养基含糖量分别为20%、30%、40%、50%。
1.3.5 菌株碳源同化能力测定
将重悬种子液接种至不同碳源同化培养基,按1.3.4部分的方法培养后测定OD600nm值。
1.3.6 固态发酵产酶特性研究
取3.6 mL种子液加入麸曲固态发酵培养基30 ℃培养72 h,期间每天翻拌1次。发酵结束后将固态发酵物真空冷冻干燥,粉碎混匀,测定称取1.0 g(精确至0.001 g)样品,加入装有50 mL对应酶反应pH的缓冲液且带有玻璃珠的150 mL锥形瓶中,在振荡器上150 r/min振荡40 min,吸取适量悬液8 000 r/min离心2 min取上清液即为粗酶液,取粗酶液进行酶活检测。
1.3.7 生玉米淀粉液态发酵试验
将1.3.6部分所得到的发酵物8 g接入151 g生玉米淀粉液态发酵培养基,30 ℃培养72 h。结束发酵后5 000 r/min离心2 min取上清,测定乙醇含量并进行香气物质分析。
1.3.8 测定方法
高温、中温α-淀粉酶活测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[18];糖化酶活、普鲁兰酶活测定:参考GB 1886.174—2024《食品安全国家标准食品添加剂食品工业用酶制剂》[19];滤纸酶活力(filter paper activity,FPA)测定:参考QB/T 2583—2023《纤维素酶制剂》[20];酸、中、碱性蛋白酶活测定:参考GB/T 23527.1—2023《酶制剂质量要求第1部分:蛋白酶制剂》[21];脂肪酶活测定:参考GB/T 23535—2009《脂肪酶制剂》[22];生淀粉酶活测定:参考钟坤等[23]的方法并做适当修改。
乙醇含量测定:参考袁文杰等[24]的方法;香气物质分析:发酵结束后8 000 r/min离心5 min收集上清液,经0.22 μm过滤后,取5 mL过滤液加入1.5 g氯化钠,10 μL 2 g/L的四甲基二戊醇(内标)混匀,50 ℃平衡30 min,进行挥发性成分分析。气相色谱条件:DB-HeavyWAX色谱柱(30m×0.25mm×0.25 μm),进样口温度250 ℃,载气为氦气(He);升温程序:40℃保持3min,以4℃/min升至200℃,保持0min;以10℃/min升至250 ℃,保持3 min。未知化合物通过与美国国家标准与技术研究院(national institute of standards and technology,NIST)数据库进行比对鉴定,选择匹配度>800的化合物,进行定性;采用内标法进行定量分析。
1.3.9 数据处理
每组试验重复3次,分别使用SPSS 26.0、R 4.2.1进行数据分析与绘图。
2 结果与分析
2.1 高产淀粉酶菌株分离纯化及形态学观察
将样品稀释涂布于淀粉酶筛选培养基,筛选出1株有较大的透明圈的菌株AMCC32244,将该菌株多次划线纯化培养,菌株在YPD培养基上的生长特性见图1。由图1A可知,该菌的菌落呈绒毛状质地、圆形、白色、干燥不透明,表面及边缘呈菌丝状,菌落与培养基结合紧密不易挑取;由图1B可知,菌株单细胞呈卵形、无色透明,大小为3.0 μm×7.3 μm,多极出芽繁殖,长大的子细胞与母细胞不分离并继续出芽,连接成长链,并有分枝,最终形成树枝状菌丝体;细胞之间的连接处缢缩没有横隔,菌丝为藕节状,呈明显的假菌丝特征。

图1 高产淀粉酶菌株AMCC32244菌落(A)及细胞(B)形态
Fig.1 Morphology of colony (A) and cell (B) of a high amylaseproducing strain AMCC32244
2.2 分子生物学鉴定
根据测序结果构建菌株的系统发育树,结果见图2。由图2可知,菌株AMCC32244与扣囊复膜酵母(Saccharomycopsis fibuligera)聚为同一支,同源性达100%。结合形态分析,鉴定该菌株为扣囊复膜酵母(Saccharomycopsis fibuligera),于2023年10月保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M20231788。
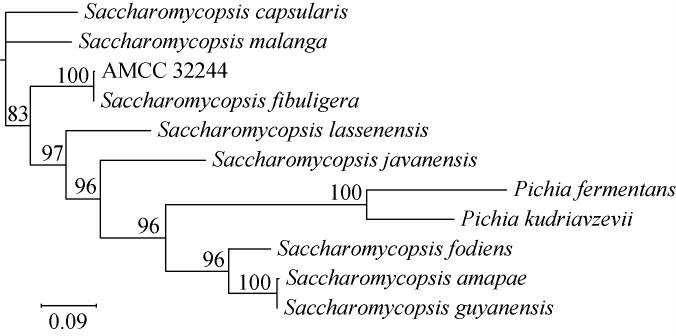
图2 基于ITS基因序列菌株AMCC32244的系统发育树
Fig.2 Phylogenetic tree of the strain AMCC32244 based on ITS gene sequences
2.3 菌株耐受能力分析
由图3可知,扣囊复膜酵母AMCC32244在培养温度40℃及培养基pH3.0、乙醇含量8%、葡萄糖含量60%条件下均能生长,表明该菌株有较好的适应发酵时高温、酸性、高乙醇以及高糖的能力。


图3 扣囊复膜酵母AMCC32244耐受性实验结果
Fig.3 Tolerance test results of Saccharomycopsis fibuligera AMCC32244
2.4 菌株碳源同化能力分析
由表1可知,扣囊复膜酵母AMCC32244菌株能利用木糖、阿拉伯糖、果糖、葡萄糖、蜜二糖、纤维二糖、麦芽糖、海藻糖、蔗糖、松三糖、水苏糖、棉子糖、菊糖、普鲁兰多糖和可溶性淀粉等15种碳源。这表明该菌株具有广谱的底物适用性,具有应用于多种原料(如谷物类、薯类、水果类等)发酵的潜力。
表1 扣囊复膜酵母AMCC32244菌株碳源利用情况
Table 1 Carbon source utilization of Saccharomycopsis fibuligera AMCC32244

注:“+”表示结果为阳性;“-”表示结果为阴性。
木糖 阿拉伯糖 半乳糖 鼠李糖 果糖 葡萄糖+蜜二糖+松三糖++--++纤维二糖+水苏糖+麦芽糖+棉子糖+海藻糖+菊糖+蔗糖+普鲁兰多糖+乳糖-可溶性淀粉+
2.5 固态发酵产酶能力分析
由表2可知,扣囊复膜孢酵母AMCC32244菌株产葡糖淀粉酶活为82 539.14 U/g,70 ℃条件下的α-淀粉酶活为39 904.12 U/g,生淀粉酶活为4 557.62 U/g。生淀粉酶是对不经过蒸煮糊化的生淀粉颗粒能够表现出强水解活性的酶类,可以将传统工艺中的淀粉糊化、液化、糖化合并为一步直接进行糖化[25]。同时,首次发现扣囊复膜酵母种属具有普鲁兰酶活性。普鲁兰酶是一类淀粉脱支酶,可高效切割多聚葡萄糖类底物分支部位的α-1,6-糖苷键[26]。该酶常与糖化酶复配使用,应用于淀粉糖化过程中。两者协同作用可有效提高淀粉利用率和糖化得率,并显著缩短糖化时间[27]。这表明了扣囊复膜孢酵母AMCC32244菌株对于减少发酵生产中外加酶的投入、提高生产效率具有较高的开发应用潜力。
表2 扣囊复膜孢酵母AMCC32244的产酶活力情况
Table 2 Activity of enzymes produced by Saccharomycopsis fibuligera AMCC32244
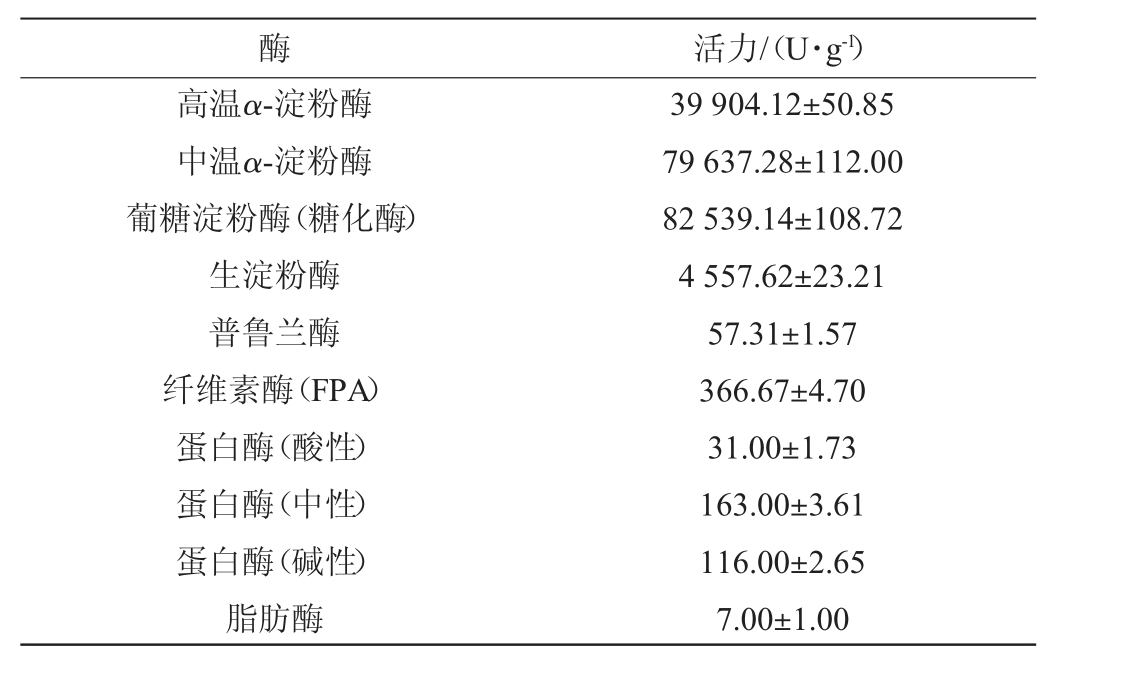
酶活力/(U·g-1)高温α-淀粉酶中温α-淀粉酶葡糖淀粉酶(糖化酶)生淀粉酶普鲁兰酶纤维素酶(FPA)蛋白酶(酸性)蛋白酶(中性)蛋白酶(碱性)脂肪酶39 904.12±50.85 79 637.28±112.00 82 539.14±108.72 4 557.62±23.21 57.31±1.57 366.67±4.70 31.00±1.73 163.00±3.61 116.00±2.65 7.00±1.00
2.6 生玉米淀粉液态发酵产乙醇、产香气物质分析
用扣囊复膜AMCC32244菌株进行生玉米淀粉发酵后发酵上清乙醇含量可达9 434 mg/L。
通常香气活性值(OAV)>1即表示该物质散发的气味达到人类可嗅探出的阈值范围,可被嗅闻出[28]。由表3可知,发酵产生了苯乙醇、异戊醇、β-紫罗兰酮、二氢-β-紫罗兰酮、4-乙烯基愈创木酚等果香、花香味物质;γ-壬内酯、棕榈酸乙酯、反式-4-癸烯酸乙酯等蜡香、奶油香物质,且以上物质OAV值均>1,其中苯乙醇含量最高,达36.34 mg/L。苯乙醇主要呈玫瑰花香、花粉香,能提供令人愉悦的风味,是一种重要的天然风味物质[29]。4-乙烯基愈创木酚是白酒、葡萄酒、啤酒、酱油等发酵产品的重要呈香物质[30]。而3-甲硫基丙醇、辛酸、丁酸等可能呈不良风味的物质OAV值均<1。结果表明,扣囊复膜AMCC32244菌株具有优秀的产香能力,有助于增加发酵产品的风味。
表3 生玉米淀粉液态发酵上清液香气成分分析
Table 3 Analysis of aroma components in raw corn starch liquid fermentation supernatant

注:此处仅选择匹配因子>85的物质展示;/表示阈值未知。
保留时间/min CAS编号 化合物 气味 阈值/(mg·L-1)质量浓度/(mg·L-1) OAV 32.292 9 11.739 9 30.773 8 35.097 7 12.659 0 26.059 4 8.125 5 19.159 2 38.988 3 40.738 8 16.387 7 22.768 8 24.821 3 29.902 4 29.135 7 19.573 5 21.497 4 23.092 6 36.116 8 35.216 8 41.274 1 31.711 9 15.916 2 27.497 5 25.268 9 45.093 3 32.940 5 25.187 9 19.916 4 24.997 5 30.273 8 21.273 5 60-12-8 123-51-3 142-62-1 104-61-0 123-66-0 76649-16-6 78-83-1 106-32-1 7786-61-0 628-97-7 111-27-3 111-87-5 107-92-6 103-45-7 101-97-3 3391-86-4 100-52-7 79-31-2 124-07-2 2785-89-9 131-11-3 2021-28-5 106-30-9 91-20-3 110-38-3 6114-18-7 14901-07-6 98-86-2 2198-61-0 122-78-1 17283-81-7 2396-84-1苯乙醇异戊醇己酸γ-壬内酯己酸乙酯反式-4-癸烯酸乙酯异丁醇辛酸乙酯4-乙烯基愈创木酚棕榈酸乙酯正己醇正辛醇丁酸乙酸苯乙酯苯乙酸乙酯1-辛烯-3-醇苯甲醛异丁酸辛酸4-乙基愈创木酚邻苯二甲酸二甲酯苯丙酸乙酯庚酸乙酯萘癸酸乙酯反油酸乙酯β-紫罗兰酮苯乙酮己酸异戊酯苯乙醛二氢-β-紫罗兰酮山梨酸乙酯新鲜面包香、清甜的玫瑰样花香、月季花香,花粉香味水果香,花香汗臭,动物臭,酸臭,脂肪臭、窖泥臭气奶油香,椰子香,奶油饼干香甜香,水果香,窖香,青瓜香蜡香和梨香,有皮革气息酒精、溶剂味梨子香,荔枝香,水果香,甜香,百合花香呈强烈香辛料、丁香和发酵似香气呈微弱蜡香、果爵和奶油香气水果香蔷薇芳香、柑橘香汗臭,酸臭,窖泥臭桃子香气玫瑰花香,桂花香,洋槐花香,蜂蜜香,花香青草香,水果香,尘土风味,油脂风味、蘑菇香、草药香杏仁香,坚果香有持久、刺鼻的气息,稀释后有奶香、甜香、干酪香、果香油脂臭、水果酸气味、汗臭味甜香,花香,水果香,香瓜香,温暖辛香、药香微带芳香气味蜜菠萝香,水果糖香,蜂蜜香,水果香,花香果香、青香、蜡香、康酿克酒香,有菠萝蜜、香蕉、草莓风味樟脑丸味、卫生球臭菠萝香,水果香,花香花香、果香以及油脂气息紫罗兰花香气,木香香韵花香,有愉快的芳香气味。呈苹果和菠萝似香味花香,洋水仙的优雅香气木香、花香、果香香气甜香、果香及菠萝蜜气味0.564 23 0.004 89 0.009 7 0.005/6.505 2 0.019 3 0.012 02 1 0.005 6 0.042 2.4 0.249 59 0.155 55 0.001 5 0.750 89 6.550 5 0.987 0.089 25/125.21 0.001 9 0.5 0.005/0.008 4 0.065 0.32 0.004 0.001/36.34 25.01 8.50 5.80 3.06 3.02 1.80 1.38 1.26 1.17 1.14 0.64 0.57 0.53 0.47 0.45 0.43 0.34 0.30 0.26 0.24 0.19 0.17 0.17 0.15 0.14 0.14 0.12 0.10 0.07 0.07 0.04 64.41 6 253.75 0.10 598.27 611.69/0.28 71.55 104.57 1.17 203.62 15.30 0.24 2.14 2.99 301.73 0.57 0.05 0.30 2.88/0.00 90.87 0.33 29.35/16.24 1.83 0.31 17.24 65.65/
此外,表5呈现香气物质还包括一些抗氧化、抗炎等活性成分,如4-乙烯基愈创木酚具有抗氧化、消炎活性[31];4-乙基愈创木酚是自由基消除剂,具有抗氧化、预防疾病、增强人体免疫力、抑菌、抗感染等功效[32];β-紫罗兰酮具有抗癌、抗菌抗炎、抗微生物和降血脂等有益人体健康的功效[33];丁酸能促进肠系膜淋巴结发育,调节抗炎信号通路,改善肠道上皮屏障功能[34];己酸、庚酸、辛酸等中链脂肪酸具有抗菌、抗炎和抗氧化等多种生物活性[35]。结果表明,扣囊复膜AMCC32244菌株具有增加发酵产品抗氧化、抗炎等活性益生功能的潜力。
3 结论
本研究筛选出的菌株AMCC32244经形态学和分子生物学鉴定为扣囊复膜孢酵母(Saccharomycopsis fibuligera),具有耐高温、高糖、低pH和乙醇的特性,且可同化包括木糖、纤维二糖、普鲁兰多糖等至少15种碳源,能在特殊的发酵环境中生长,用于多种原料的发酵。该菌株可在麸曲发酵中产糖化酶、α-淀粉酶、蛋白酶、纤维素酶、脂肪酶、普鲁兰酶等多种酶活性,丰富的酶系可有效提高淀粉利用率和糖化得率,并显著缩短糖化时间,对于减少发酵生产投入、提高生产效率具有较高的应用价值与开发潜力。其用于生玉米淀粉液态发酵,发酵液富含花果香味香气物质,在麸曲固态发酵和淀粉质原料液态发酵上具有广阔的应用前景。后续会进行该菌株与其他酿造用菌株的混菌发酵研究,探究其相互作用机理,以期为后期发酵菌剂开发提供理论基础和依据。
[1]戎梓溢,白茹,闫学娇,等.酱香型白酒酿造微生态中酵母菌的研究进展[J].食品研究与开发,2022,43(13):180-188.
[2]WANG D K,HE M W,ZHANG M,et al.Food yeasts:occurrence,functions,and stress tolerance in the brewing of fermented foods[J].Crit Rev Food Sci Nutr,2023,63(33):12136-12149.
[3]王居伟,韩培杰,王雪薇,等.白酒发酵过程中常见酵母菌扣囊复膜酵母的研究进展[J].广西科学,2020,27(1):1-9.
[4]张国豪,任飞,陈虹,等.不同直链淀粉含量大米对清香型白酒风味物质的影响[J].中国酿造,2024,43(1):99-105.
[5]张姝,李潇,王爽,等.传统醋曲储存过程中的微生物多样性[J].微生物学通报,2023,50(11):4954-4965.
[6]张杰,程伟,李娜,等.夏秋茶大曲与传统中温大曲中微生物群落及多样性研究[J].酿酒科技,2021(11):36-44.
[7]CHEN L,CHI Z M,CHI Z,et al.Amylase production by Saccharomycopsis fibuligera A11 in solid-state fermentation for hydrolysis of Cassava starch[J].Appl Biochem Biotechnol,2010,162:252-263.
[8]MACHIDA M, OHTSUKI I, FUKUI S, et al.Nucleotide sequences of Saccharomycopsis fibuligera genes for extracellular beta-glucosidases as expressed in Saccharomyces cerevisiae[J].Appl Environ Microbiol,1988,54(12):3147-3155.
[9]周阳子,边名鸿,刘文艺,等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业,2020,46(2):79-84.
[10]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425.
[11]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[12]王奇盛,高瑞杰,缪礼鸿,等.酵母菌混合发酵制备米酒及其工艺优化[J].中国酿造,2022,41(7):155-161.
[13]雷炎,刘梦琦,易秦振,等.扣囊复膜酵母在红枣酒中的应用[J].食品研究与开发,2021,42(5):131-136.
[14]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[15]METHNER Y,MAGALHÃES F,RAIHOFER L,et al.Beer fermentation performance and sugar uptake of Saccharomycopsis fibuligera-A novel option for low-alcohol beer[J].Front Microbiol,2022,13:1011155.
[16]应玲云,伍时华,赵东玲,等.烧酒曲中扣囊复膜酵母的分离及鉴定[J].食品与发酵工业,2013,39(1):146-150.
[17]王志男,杨佳,李新生,等.扣囊复膜酵母生物学性状及生理生化特性研究[J].陕西理工大学学报(自然科学版),2022,38(3):39-46.
[18]曾东方,杨帆,聂欢欢.DNS法对食用菌发酵液淀粉酶活力的测定[J].现代农业科技,2011(11):16-18.
[19]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 1886.174—2024 食品安全国家标准食品添加剂食品工业用酶制剂[S].北京:中国标准出版社,2024.
[20]中华人民共和国工业和信息化部.QB/T 2583—2023 纤维素酶制剂[S].北京:中国标准出版社,2023.
[21]国家市场监督管理总局,国家标准化管理委员会.GB/T 23527.1—2023 酶制剂质量要求第1部分:蛋白酶制剂[S].北京:中国轻工业出版社,2023.
[22]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23535—2009 脂肪酶制剂[S].北京:中国标准出版社,2009.
[23]钟坤,谭德冠,孙雪飘,等.一株木薯生淀粉糖化酶菌株的分离及酶学性质研究[J].热带作物学报,2012,33(7):1239-1244.
[24]袁文杰,孔亮,孜力汗,等.高效液相色谱法测定克鲁维酵母菊芋发酵液中的乙醇,糖和有机酸类代谢成分[J].分析化学,2009,37(6):5.
[25]张美远,廖桂艳,宁远妮,等.草酸青霉转录因子POX03446对生淀粉酶产量调控的初步研究[J].基因组学与应用生物学,2020,39(1):138-144.
[26]LI X X, BAI Y X, JI H Y, et al.Functional characterization of tryptophan437 at subsite+2 in pullulanase from Bacillus subtilis str.168[J].Int J Biol Macromol,2019,133:920-928.
[27]刘恩芬,赵晓晨,周国福,等.双酶协同对烟梗提取物中淀粉降解效应的研究[J].江西农业学报,2023,35(7):26-31.
[28]陈芝飞,蔡莉莉,郝辉,等.香气活力值在食品关键香气成分表征中的应用研究进展[J].食品科学,2018,39(19):329-335.
[29]范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
[30]黄昊,哈祖德,顾京赛,等.西藏传统青稞酒酿造用藏曲中主要酵母菌的分离及酿造特性研究[J].食品与发酵工业,2021,47(2):8-14.
[31]尚通明,谢天柱,仲慧,等.赤芍超临界萃取、化学成分及其抗氧化性能研究[J].食品科学,2007,28(10):38-41.
[32]ZHAO D R,JIANG Y S,SUN J Y,et al.Anti-inflammatory mechanism involved in 4-ethylguaiacol-mediated inhibition of LPS-induced inflammation in THP-1 cells[J].J Agr Food Chem,2019,67:1230-1243.
[33]祝纤纤,仝涛. β-紫罗兰酮的生物活性与其衍生物的构效关系研究进展[J].食品安全质量检测学报,2023,14(8):101-108.
[34]刘路琼,陈通,张永进,等.丁酸对TNFα所致肠上皮屏障损伤的保护作用[J].昆明医科大学学报,2023,44(10):10-17.
[35]孙玲,吴俊俊.中链脂肪酸研究进展及应用现状[J].中国食品添加剂,2022,33(12):50-55.