由于消费者生活水平及健康意识的不断提高,发酵谷 物或半谷类饮料越来越多的成为乳发酵产品的替代品[1]。已有大量研究表明,谷物发酵饮料中存在丰富的乳酸菌资源并且其具有明显的益生作用。如AKMAN P K等[2]通过传统培养方法和聚合酶链式反应(polymerase chain reaction,PCR)从土耳其传统饮料Gilaburu和Shalgam中分离并鉴定出的发酵乳杆菌(Lactobacillus fermentum)、戊糖乳杆菌(Lactobacilluspentosus)、植物乳杆菌(Lactobacillusplantarum)具有较高的益生菌潜力;张悦等[3]从酸粥中筛选出的干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillus paracasei)、哈尔滨乳杆菌(Lactobacillus harbinensis)具有较强耐酸耐胆盐能力;QUEIROZ L L等[4]从波杂(Boza)中得到的乳酸小球菌(Pediococcus acidilactici)和戊糖片球菌(Pediococcus pentosaceus)对单增李斯特菌(Listeria monocytogenes)、粪肠球菌(Enterococcus faecalis)及希拉肠球菌(Enterococcus hela)等病原菌有抑制作用;秦慧彬等[5]研究发现,从酸粥中分离的戊糖乳杆菌(Lactobacillus pentosus)可以提高酸粥的游离氨基酸含量。
波杂是新疆地区柯尔克孜族的非物质文化遗产,它是一种由谷物(如小麦、玉米、小米、大麦或燕麦等)自然发酵而成的传统发酵饮料,具有解腻、促消化等功效[6-7]。玛格孜木是新疆伊犁特克斯县哈萨克族的一种传统谷物发酵饮料,也是该县非物质文化遗产,其以糜子为原料自然发酵制得,在民间用于醒脑,消暑,治疗失眠和降糖降脂[8]。目前,这两种饮料生产仍处于传统的家庭作坊生产,自然发酵模式,成品存在严重胀气和过酸化现象,使得该产品的发酵过程不可控,导致产品质量不稳定,严重制约其工业化、规模化生产[9]。因此,谷物发酵饮料要实现工业化生产,重点方向应在于分离纯化参与发酵的有益菌[10],建立菌种库,将其制成发酵剂,使发酵实现菌种可知,发酵过程可控,产品稳定,益生功能明确。
本研究利用选择性培养法对新疆伊犁地区具有典型代表的传统自然发酵谷物饮料—波杂和玛格孜木中的乳酸菌进行分离,并采用形态学观察和分子生物学技术对分离菌株进行鉴定,并通过测定乳酸菌生长性能,产酸、耐酸性能,溶血性,抑菌活性,抗氧化活性、降解生、熟淀粉的能力以及挥发性风味成分评价其发酵特性,为谷物发酵饮料专用发酵剂的研发提供参考,有助于实现工业化生产目标。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
玛格孜木:新疆伊犁特克斯县喀拉达拉乡国土资源所东北(X765北)哈萨克族牧民家;波杂:新疆伊犁特克斯县阔克铁热克柯尔克孜民族乡柯尔克孜族牧民家;糜米(塔尔米):购自新疆维吾尔自治区乌鲁木齐市沙依巴克区新北园春副食市场。
金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、鼠李糖乳杆菌(LactobacillusrhamnosusGG,LGG)ATCC7496:广东环凯微生物科技有限公司;沙门氏菌(Salmonella):新疆农业科学院微生物应用研究所。
1.1.2 化学试剂
可溶性淀粉(生化试剂)、氢氧化钠(分析纯):天津市北联精细化学品开发有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、冰乙酸、L-抗坏血酸、无水亚硫酸钠(均为分析纯):天津市致远化学试剂有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:成都福际生物技术有限公司;2,2'-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2'-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)、2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)、L-抗坏血酸(均为分析纯):上海麦克林生化科技股份有限公司;无核酸酶水(Nuclease-Free Water):北京鼎国昌盛生物技术有限责任公司。
1.1.3 培养基
MRS琼脂培养基、MRS肉汤培养基、葡萄糖酵母浸粉蛋白胨(glucose yeast extract peptone,GYP)白亚琼脂培养基、沃勒斯坦(Wallerstein laboratory,WL)营养琼脂培养基、哥伦比亚血平板:青岛高科技工业园海博生物技术有限公司。
含1%水溶性淀粉MRS培养基:蛋白胨1.0%,牛肉浸粉0.8%,酵母浸粉0.4%,水溶性淀粉1.0%,磷酸氢二钾0.2%,柠檬酸氢二铵0.2%,乙酸钠0.5%,硫酸镁0.02%,硫酸锰0.04‰。121 ℃高压蒸汽灭菌15 min。
营养琼脂(nutrient agar,NA)平板:蛋白胨1%,牛肉浸粉0.3%,氯化钠0.5%,琼脂1.5%。121 ℃高压灭菌15 min。
营养肉汤(nutrient broth,NB)培养基:蛋白胨1%,牛肉浸粉0.3%,氯化钠0.5%。121 ℃高压灭菌15 min。
发酵培养基:10%糜米,121 ℃高压灭菌15 min。
1.2 仪器与设备
SW-CJ-2D型双人净化工作台:浙江孚夏医疗科技有限公司;HPX-9272MBE电热恒温培养箱:上海博讯实业有限公司;N-300M荣光显微镜:宁波永新光学股份有限公司;pHS-25 PH计:上海雷磁仪器厂;2-16R台式高速冷冻离心机:湖南恒诺仪器设备有限公司;UV-1200紫外/可见分光光度计:上海美析仪器有限公司;Epoch微孔板分光光度计、Epoch 2全波长酶标仪:美国Bio Tek公司;PEN3电子鼻:德国AIRSENSE公司;PAL-1手持折光仪:日本ATAGO公司;BSD-YX3200立式智能精密摇床:上海博迅医疗生物仪器股份有限公司;TOne 96聚合酶链式反应(polymerase chain reaction,PCR)仪:德国耶拿分析仪器公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
参考林瑛兰等[17]的方法,玛格孜木和波杂样品混匀,无菌条件下各取1 mL至装有9 mL无菌水的试管中,10倍梯度连续稀释后,取10-3、10-4、10-5菌悬液各100 μL分别接种至MRS、GYP、WL固体培养基上,每个梯度做3个平行,37 ℃倒置培养48 h。挑取并记录菌落形态明显不同的单菌落,连续2次划线分离后,用瓷珠菌种保存管保存。挑取分离菌株单菌落进行革兰氏染色,进行形态学观察。
1.3.2 筛选菌株的分子生物学鉴定
使用细菌DNA提取试剂盒提取分离株基因组DNA,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系(50 μL):2×Power Taq PCR GreenMix 25 μL,DNA模板2 μL,上下引物各1 μL,无核酸酶水(Nuclease-Free Water)21 μL。PCR扩增条件:94 ℃预变性4 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1.5 min,共30个循环,72 ℃再延伸10 min。PCR产物在1%琼脂糖凝胶上检测后,由生工生物工程(上海)股份有限公司做双向测序,将测序结果采用Dnaman 8.0软件双向拼接与去引物后,提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)网站的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性分析,明确分离菌株的分类学地位。
1.3.3 分析检测
(1)玛格孜木和波杂理化指标
pH值:采用pH计测定;可滴定酸度:参照GB 12456—2021《食品中总酸的测定》中的pH计电位滴定法进行测定;可溶性固形物含量:使用手持折光仪测定;还原糖含量:参考张珣等[11]的方法测定。
(2)筛选菌株的生长特性和产酸特性
参照韦庆旭等[18]的方法,取1颗附有分离菌株的磁珠置于5 mL新鲜MRS肉汤培养基中,37 ℃、140 r/min振荡培养24 h后,取1%(V/V)菌液接种至新的MRS肉汤培养基,37 ℃、140 r/min振荡培养24 h后得到活化菌液,备用。接种1%(V/V)的活化菌液至200 mL MRS肉汤培养基,37 ℃、140 r/min振荡培养,前24 h每隔2 h取样,24 h后每隔12 h取样,用酶标仪测定OD600 nm值,同时测定培养基的pH值,每次测定重复3次。以时间为横坐标,OD600nm值和pH值为纵坐标绘制分离菌株生长曲线和产酸曲线。
(3)酸碱耐受性
用1 mol/L HCl和1 mol/L NaOH将MRS肉汤培养基pH值分别调至2.5、3.5、4.5、5.5、6.5、7.5,121 ℃灭菌15 min。菌液活化后,再按1%(V/V)的接种量接种至不同pH值的5 mL MRS肉汤培养基中,于37 ℃、140 r/min条件下振荡培养16 h,测第0小时和第16小时的OD600nm值,计算吸光度值的变化量(ΔOD600nm值)。
(4)产气性及溶血性
用空白MRS肉汤培养基调整活化菌液吸光度值为1.0±0.02,按照2%(V/V)的接种量接种至9 mL装有杜氏小管的MRS肉汤培养基中,于37 ℃条件下静置培养24 h后,以未接菌的为空白对照(CK),观察杜氏小管内产气情况。
采用血琼脂平板法检测菌株溶血活性[12]。取3μL活化菌液点接到哥伦比亚血平板上,以金黄色葡萄球菌ATCC25923为对照,37 ℃培养24 h,观察菌落周围是否出现透明圈,若出现透明圈,则具有溶血活性。
(5)抑菌能力
采用牛津杯法测定细菌的抑菌活性[13]。将1%(V/V)的沙门氏菌(Salmonella)接种于50 mL NB培养基中,于37 ℃、140 r/m条件下振荡培养14 h。调整菌液吸光度值为0.05±0.02,取100 μL均匀涂布至NA平板上。将活化好的细菌按2%(V/V)的接种量接种至5 mL MRS肉汤培养基中,于37 ℃、140 r/min条件下振荡培养24 h后得到发酵液。发酵液于4 ℃、8 000 r/min条件下离心5 min,得到发酵液上清液。用直径8 mm牛津杯于NA平板制4孔,其中3孔各添加100 μL发酵液上清液,另一个孔添加100 μL空白MRS肉汤培养基作为对照,37 ℃静置培养24 h,记录其抑菌圈直径,抑菌圈直径>12 mm,说明具有抑菌活性[14-15]。
(6)抗氧化活性
筛选菌株活化菌液按1%(V/V)的接种量接种至5 mL MRS肉汤培养基中,于37 ℃、140 r/min条件下振荡培养24 h后得到发酵液。发酵液于4 ℃、12 000 r/min条件下离心10 min,取发酵液上清液测定自由基清除率,以LGG为阳性对照[16]。
DPPH自由基清除率参考TONG T等[17]的方法测定;ABTS自由基清除率参考KIM N J等[18]的方法测定;超氧阴离子自由基清除率参考吴祖芳等[19]的方法测定。自由基清除率计算公式如下:
式中:A1为样品组吸光度值;A2为空白组吸光度值;A0为对照组吸光度值。
(7)淀粉酶酶活测定
采用DNS比色法测定α-淀粉酶活性[20]及葡萄糖淀粉酶活性[21-22]。调整活化菌液OD600nm值为1.0±0.02,按2%的接种量接种于5 mL含1%水溶性淀粉-MRS培养基中,于37 ℃、140 r/min条件下振荡培养24 h,得到发酵液。取1 mL发酵液于4 ℃、8 000 r/min条件下离心5 min,上清液即为粗酶液。
α-淀粉酶酶活定义为:在40 ℃,pH 5.6条件下,5 min内每mL酶液降解淀粉生成1 μg麦芽糖所需酶量为一个酶活单位(U/mL)。葡萄糖淀粉酶酶活定义为:在40 ℃,pH4.6条件下,5 min内每mL酶液降解淀粉生成1 μg葡萄糖所需酶量为一个酶活单位(U/mL)[23]。
(8)电子鼻检测
选择生长能力好、产酸强的筛选菌株以及商业菌株LGG进行活化,菌液活化后,在50 mL发酵培养基中,接种5%(V/V)过夜培养的菌液,35 ℃条件下静置培养2 d后,通过电子鼻技术分析接菌和未接菌空白(CK)样品的挥发性气味以及产香气成分的差异[24]。电子鼻传感器及性能描述见表1。
表1 电子鼻传感器及性能描述
Table 1 Electronic nose sensor and performance description
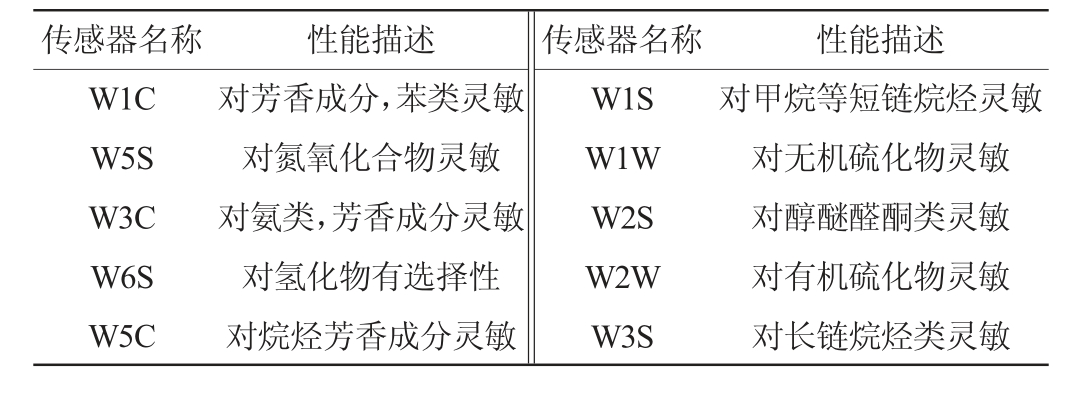
传感器名称 性能描述 传感器名称 性能描述W1C W5S W3C W6S W5C对芳香成分,苯类灵敏对氮氧化合物灵敏对氨类,芳香成分灵敏对氢化物有选择性对烷烃芳香成分灵敏W1S W1W W2S W2W W3S对甲烷等短链烷烃灵敏对无机硫化物灵敏对醇醚醛酮类灵敏对有机硫化物灵敏对长链烷烃类灵敏
1.3.4 数据处理
采用Microsoft Office 2019进行数据统计,SPSS 26.0统计软件处理数据并进行方差显著性分析,结果以“平均值±标准差”表示,运用电子鼻配套软件WinMuster进行主成分分析(principal component analysis,PCA)和载荷(Loadings)分析及绘图,采用Origin 2021软件绘图。
2 结果与分析
2.1 玛格孜木和波杂理化指标分析
玛格孜木与波杂样品在储存前后的理化指标的变化见表2。由表2可知,随着储存时间延长,玛格孜木与波杂pH值均略有升高,可滴定酸度均降低,可能与微生物利用有机酸以及微生物代谢生成了碱性物质有关[26];储存期间玛格孜木可溶性固形物及还原糖显著降低(P<0.05),可能是微生物产生酶将淀粉转化为还原糖,同时以还原糖为能源供生长繁殖所需[27]。玛格孜木比波杂pH值低,但还原糖降低速度更快,说明玛格孜木中可能有更多耐酸微生物存在[28]。波杂可滴定酸显著高于玛格孜木(P<0.05),可能是因为其中乳酸菌活菌数高或产酸能力更强。
表2 玛格孜木与波杂样品在储存前后的理化指标的变化
Table 2 Changes of physicochemical indexes of Magzim and Boza samples before and after storage
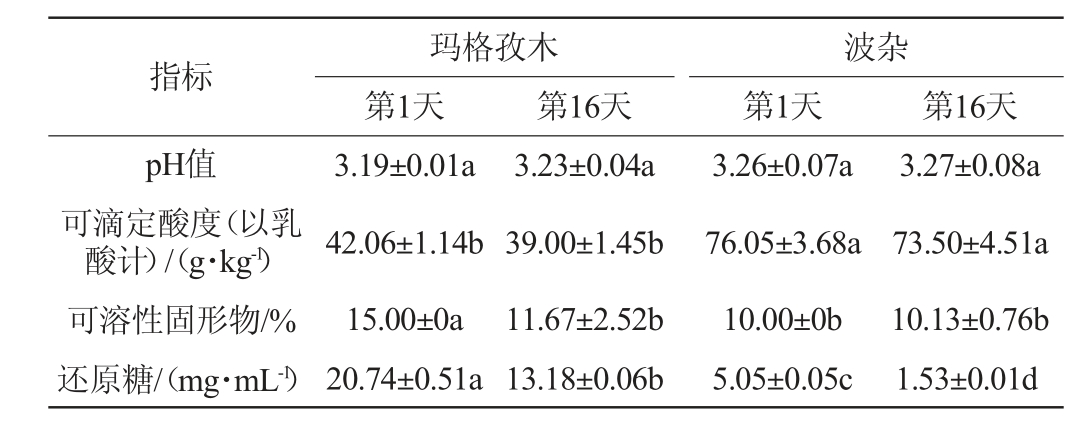
注:同一行不同小写字母表示差异显著(P<0.05)。
指标pH值可滴定酸度(以乳酸计)/(g·kg-1)可溶性固形物/%还原糖/(mg·mL-1)玛格孜木第1天第16天波杂第1天 第16天3.19±0.01a 42.06±1.14b 15.00±0a 20.74±0.51a 3.23±0.04a 39.00±1.45b 11.67±2.52b 13.18±0.06b 3.26±0.07a 76.05±3.68a 10.00±0b 5.05±0.05c 3.27±0.08a 73.50±4.51a 10.13±0.76b 1.53±0.01d
2.2 菌株的筛选分离纯化及形态学观察
从玛格孜木与波杂样品共分离纯化到12株细菌,其中从玛格孜木样品中分离得到2个属7株菌,从波杂样品中分离得到5个属5株菌。分离菌株菌落形态及显微形态见图1。由图1可知,所有分离株在不同培养基上的颜色不同,包括瓷白色、乳白色、墨绿色等,细菌菌落均呈圆形、凸起或微凸、表面光滑、较湿润、边缘整齐。所有菌株革兰氏染色均为阳性、分为长杆状、短杆状和球状。

图1 筛选菌株的菌落及显微形态
Fig.1 Colony and microscopy morphology of screened strains
2.3 筛选菌株的分子生物学鉴定
筛选菌株的16S rDNA基因序列同源性分析结果见表3。
表3 筛选菌株的16S rDNA序列同源性分析
Table 3 16S rDNA sequence homology analysis of screened strains
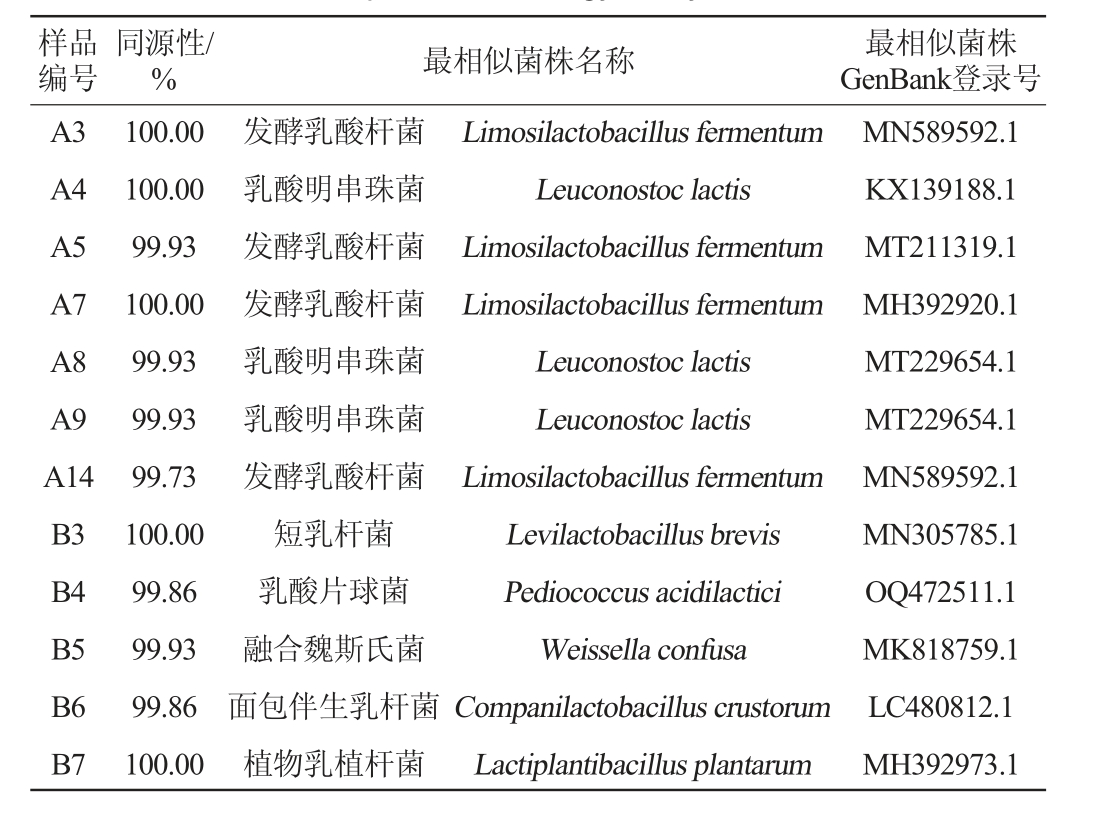
样品编号同源性/%最相似菌株名称 最相似菌株GenBank登录号A3 A4 A5 A7 A8 A9 A14 B3 B4 B5 B6 B7 100.00 100.00 99.93 100.00 99.93 99.93 99.73 100.00 99.86 99.93 99.86 100.00发酵乳酸杆菌乳酸明串珠菌发酵乳酸杆菌发酵乳酸杆菌乳酸明串珠菌乳酸明串珠菌发酵乳酸杆菌短乳杆菌乳酸片球菌融合魏斯氏菌面包伴生乳杆菌植物乳植杆菌Limosilactobacillus fermentum Leuconostoc lactis Limosilactobacillus fermentum Limosilactobacillus fermentum Leuconostoc lactis Leuconostoc lactis Limosilactobacillus fermentum Levilactobacillus brevis Pediococcus acidilactici Weissella confusa Companilactobacillus crustorum Lactiplantibacillus plantarum MN589592.1 KX139188.1 MT211319.1 MH392920.1 MT229654.1 MT229654.1 MN589592.1 MN305785.1 OQ472511.1 MK818759.1 LC480812.1 MH392973.1
由表3可知,12株分离株经BLAST序列比对后为7个属7个种。从玛格孜木中分离出4株发酵乳酸杆菌(Limosilactobacillus fermentum),3株乳酸明串珠菌(Leuconostoc lactis);从波杂中分离出1株乳酸片球菌(Pediococcus acidilactici),1株短乳杆菌(Levilactobacillus brevis),1株融合魏斯氏菌(Weissella confuse),1株面包伴生乳杆菌(Companilactobacillus crustorum),1株植物乳植杆菌(Lactiplantibacillus plantarum)。波杂乳酸菌多样性高于玛格孜木,可能是因为波杂的原料较玛格孜木更加丰富。
2.4 筛选菌株的生长和产酸特性
由图2可知,波杂筛选的菌株中,菌株的生长和产酸能力是选择发酵剂时的重要参考指标,生长速度快,产酸能力强的益生菌更受青睐[29-30]。观察筛选菌株在MRS肉汤培养基中的生长状况和产酸能力,结果见图2。由图2可知,波杂筛选的菌株中,菌株B3的对数生长期最长,为2~26 h,菌株B4、B5对数生长期为2~8 h,菌株B6、B7对数生长期为2~16 h,随后各菌株生长趋于稳定,48 h时OD600 nm值均>1.4。随着培养时间的延长,发酵液pH逐渐下降,培养48 h,菌株B6、B7的产酸能力最强,pH为3.8,菌株B3、B4、B5的pH在3.8~4.4。从玛格孜木中筛选的菌株中,生长能力较好的是菌株A3与A14,对数生长期均为2~16 h,第48小时OD600nm值>1.35,同时菌株A3与A14产酸能力也较强,菌株A3的pH值在0~12 h期间,从5.81降至4.27,之后趋于稳定;菌株A14的pH值在0~24 h期间从5.81降至4.29,之后趋于稳定。菌株A4、A5、A8、A9生长能力差,在48 h内OD600 nm值<1.00,且A8产酸能力最弱,48 h内pH值从5.80降至4.71。综上,相较于玛格孜木,波杂中的乳酸菌具有更好的生长和产酸能力。

图2 筛选菌株的生长曲线及产酸曲线
Fig.2 Growth and acid production curves of screened strains
2.5 酸碱耐受性
对筛选菌株进行耐酸碱试验,结果见图3。由图3可知,随着pH值的下降,乳酸菌的ΔOD600nm值均不同程度降低[31-32]。当pH值为7.5时,菌株A5、A7、A9基本不生长,对碱性环境表现出高度敏感,其余9株菌生长良好;pH 6.5~7.5范围内,菌株B3、B4、B5、B6活菌数仍在上升,说明其耐碱性能力较强;pH值为5.5~6.5范围内,所有菌株生长良好;当pH值为4.5时,A7与B5生长情况最差,基本不生长,其次为A5;pH 3.5~4.5范围内其他9株乳酸菌的生长量随pH值的降低明显下降,其中菌株A8生长情况最佳,ΔOD600 nm值为0.58~1.30,其次为A3和B7,ΔOD600nm值分别为0.22~1.24和0.30~1.16,说明其对pH 3.5~4.5的酸性环境有较好的耐受性;当pH值为2.5时,12株乳酸菌的生长受到严重抑制作用,说明所有乳酸菌对pH值为2.5的酸性环境表现出高度敏感。pH值为3.5时,玛格孜木中57.14%分离菌株的ΔOD600 nm值>0.10,而波杂中分离菌株的ΔOD600nm值均<0.10;pH值为4.5时,玛格孜木中85.71%分离菌株的ΔOD600nm值>0.10,而波杂中60%分离菌株的ΔOD600nm值>0.10,因此说明玛格孜木中的菌耐酸能力更强。
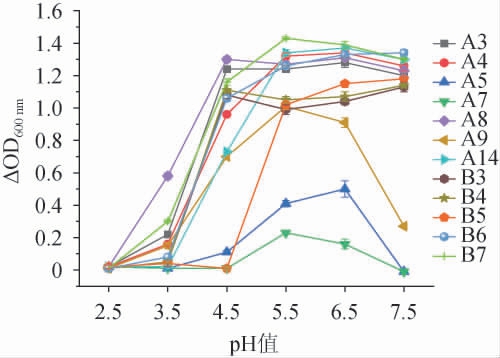
图3 筛选菌株的酸碱耐受性
Fig.3 Acid and alkali tolerance of screened strains
2.6 溶血能力及产气能力
发酵菌株的安全性直接影响到发酵食品的安全性[9],溶血性是菌种的安全性评价之一[12]。根据溶血特征可将溶血性分为两类:α溶血,特点是菌落周围有草绿色溶血圈,对人致病力差;β溶血,其特点是菌落周围出现透明溶血圈,对人体致病力强;若没有溶血圈出现则无溶血性,为γ溶血[33]。以金黄色葡萄球菌ATCC25923为对照,筛选菌株溶血活性及产气情况见表4。由表4可知,阳性对照金黄色葡萄球菌ATCC25923有透明溶血圈,为β溶血,其余12株筛选菌株均无溶血现象产生,说明均不具有溶血性。结果表明筛选出的12株菌对人体无致病力。
表4 筛选菌株溶血活性及产气情况
Table 4 Hemolytic activity and gas production of screened strains
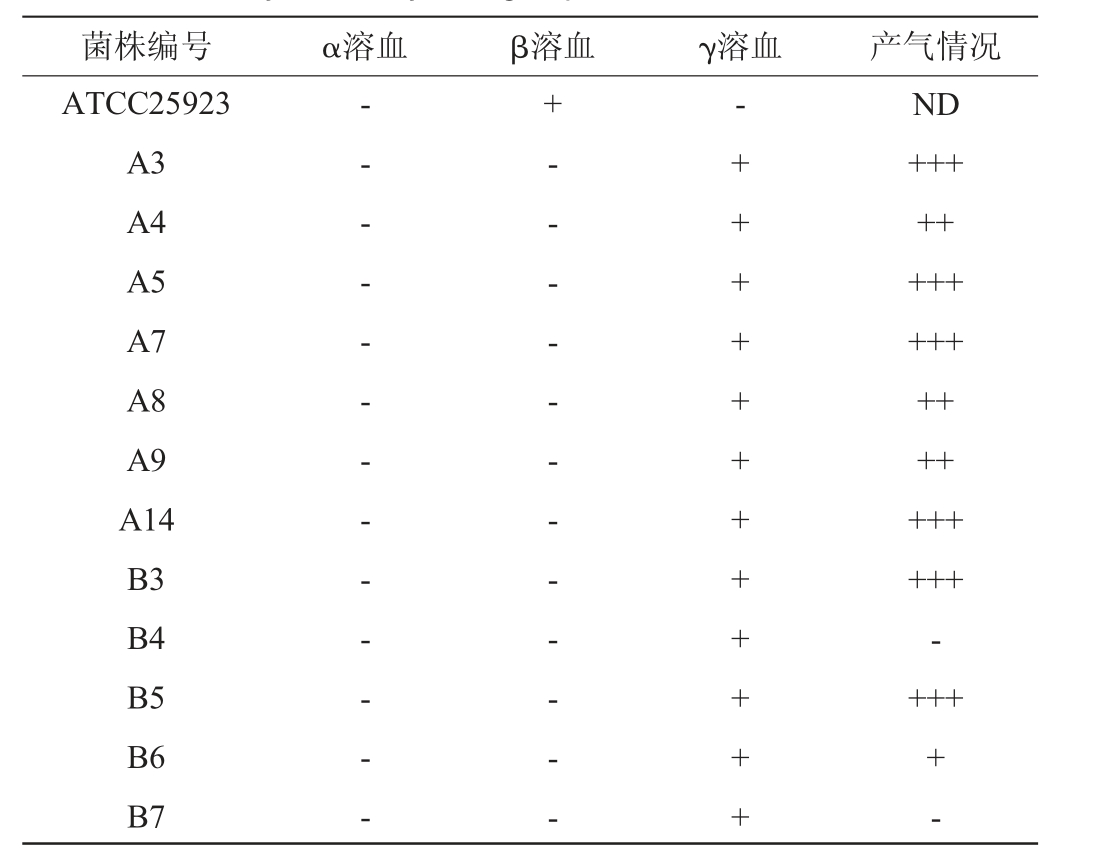
注:溶血情况:“-”表示结果呈阴性;“+”表示结果呈阳性。产气强度:“ND”表示未检测;“-”表示不产气;“+”表示产气小于1/2杜氏小管体积;“++”表示产气大于1/2且小于1杜氏小管体积;“+++”表示产气等于1杜氏小管体积。
菌株编号 α溶血 β溶血 γ溶血 产气情况ATCC25923 A3 A4 A5 A7 A8 A9 A14 B3 B4 B5 B6 B7-- - - - - - - - - - - -+- - - - - - - - - - - --++++++++++++ND+++++++++++++++++++++-++++-
乳酸菌根据代谢途径分为同型发酵乳酸菌和异型发酵乳酸菌,由表4亦可知,菌株B4与B7不产气,为同型发酵乳酸菌,均来自波杂样品。其他菌株均表现出一定产气能力,其中菌株B6相较于其他菌株,培养24 h时的产气能力最弱。与卢宏皓[28]的结果相似,在发酵前期,主要是异型乳酸菌大量存在并进行代谢。
2.7 抑菌性能
乳酸菌快速繁殖产生大量有机酸或细菌素等代谢产物,能抑制有害菌的生长繁殖[4,31,34]。不同菌株对沙门氏菌的抑菌效果见图4。
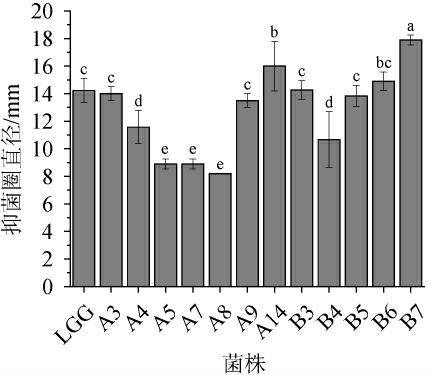
图4 筛选菌株对沙门氏菌的抑菌效果
Fig.4 Antibacterial effect of screened strains against Salmonella
不同小写字母表示差异显著(P<0.05)。
由图4可知,所有菌株抑菌能力差异较明显,对照菌株LGG抑菌圈直径为(14.23±0.87)mm,与之相比,菌株B7的抑菌能力最强,抑菌圈直径为(17.9±0.21)mm;其次分别为菌株A14与B6,抑菌圈直径分别达到(16.00±1.04)mm与(14.90±0.38)mm。除菌株A4、A5、A7、A8、B4基本不具有抑菌活性外,菌株A3、A9、B3、B5具有一定抑菌能力,且无显著性差异(P>0.05)。
2.8 抗氧化活性
生物发酵技术可显著增强谷物的体外抗氧化能力[35]。微生物的抗氧化性来源于较强的DPPH自由基、羟自由基、超氧阴离子自由基清除能力和具有较高的总还原力[16]。乳酸菌体外抗氧化结果见图5。由图5可知,所有菌株均表现出不同程度的自由基清除能力,对照菌株LGG的超氧阴离子自由基,DPPH自由基,ABTS自由基清除率分别为38.63%、74.83%、72.07%;菌株B7与B6的超氧阴离子自由基清除率显著高于对照菌株LGG(P<0.05),分别达到(53.64±3.57)%与(43.66±7.01)%,大部分菌株的DPPH自由基清除率高于对照菌株LGG,其中菌株A3最高,为(88.48±4.77)%。ABTS自由基清除率差异显著(P<0.05),菌株A4、A5、A7、A14、B7 ABTS自由基清除率均<50%;菌株A3、A8、B3、B6 ABTS自由基菌清除率均显著高于对照菌株LGG(P<0.05),清除率均超过80%,其中菌株A3的ABTS自由基清除率最强,为(90.91±1.90)%。菌株B6的三种自由基清除效果均优于对照菌株LGG。
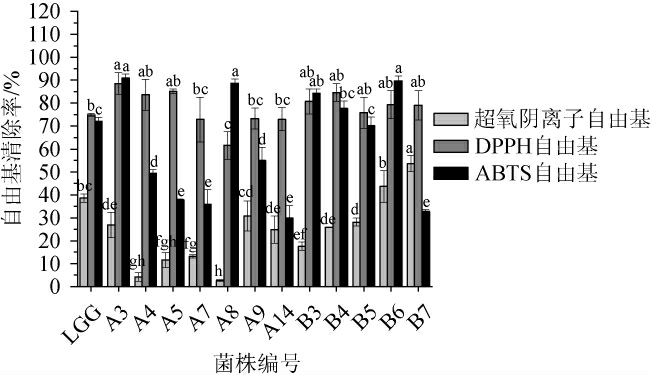
图5 筛选菌株自由基清除率测定结果
Fig.5 Determination results of free radical scavenging rates of screened strains
组间不同小写字母表示差异显著(P<0.05)。下同。
2.9 产淀粉酶能力
微生物含有丰富的酶系,能够将谷物中的大分子物质降解成利于人体吸收的小分子物质,提高其营养物质的利用率[36]。淀粉是谷物中的主要成分,其含量可达到50%~92%,在发酵过程中是微生物生长代谢的主要碳源[37]。12株筛选菌株产淀粉酶能力测定结果见图6。由图6可知,所有乳酸菌都能产α-淀粉酶和葡萄糖淀粉酶,具有降解生淀粉和熟淀粉的能力,但降解能力各不相同。α-淀粉酶酶活都显著高于葡萄糖淀粉酶酶活(P<0.05),其中来自于波杂中乳酸菌其降解生淀粉或者熟淀粉能力均高于玛格孜木中乳酸菌,尤其是生淀粉降解能力尤其显著(P<0.05)。50%的乳酸菌产α-淀粉酶降解生淀粉,如产α-淀粉酶降解生淀粉能力最强的菌株为B5(313.75±0.74)U/mL,其次分别为菌株B3(295.86±2.14)U/mL,菌株B7(283.76±1.43)U/mL,菌株B6(271.91±3.21)U/mL;玛格孜木中细菌对产α-淀粉酶降解熟淀粉能力最强的为菌株A8(278.72±2.14)U/mL,其次分别为菌株B7(272.42±0.36)U/mL,B5(255.53±0.71)U/mL。超过83%的乳酸菌产葡萄糖淀粉酶降解生淀粉能力略高于熟淀粉,其中菌株B6产葡萄糖淀粉酶降解生淀粉能力明显最强,酶活达到(189.52±2.17)U/mL,其次为菌株B7和A5,酶活分别为(171.33±1.90)U/mL和(170.38±2.17)U/mL。综合而言,筛选菌株降解生淀粉能力依次为B5>B6>B7>B3>A7>A5>A3>A9;降解熟淀粉能力依次为A8>B5>B7>A7。
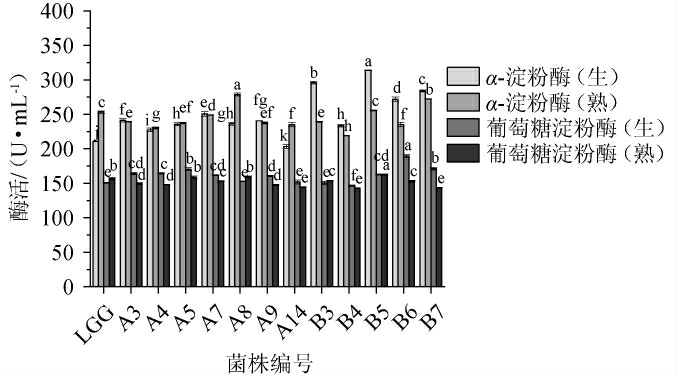
图6 筛选菌株产淀粉酶能力
Fig.6 Amylase-producing capacities of screened strains
2.10 电子鼻分析
不同乳酸菌发酵的风味不一致,为更好的分析其中的差异,选择生长能力好、产酸强的菌株A3、A7、B3、B4、B5、B6、B7、商业菌株LGG 及未接菌空白(CK)9个样品第56 s~59 s的特征响应值进行主成分分析(PCA)、雷达图和载荷(Loadings)分析,结果见图7。由图7a可知,第1和第2主成分方差贡献率之和达到99.92%,说明这两种主成分能够涵盖9个样品大部分的原始数据信息,在第1主成分上不同菌发酵的样品与CK样品之间的差异明显(P<0.05),菌株A7、B3和B5在PC1左侧部分重叠,说明其风味相似且化合物浓度较低,与雷达图中对应传感器上的响应值较低的趋势一致;菌株B7距离最远,其风味化合物浓度最强。由图7b可知,不同菌株发酵气味上的差异主要集中在W1W、W1S这些传感器对应的气味成分上。由图7c可知,所有样品的响应值在10个传感器上均有差异,菌株B7的总响应值最高。其中传感器W1W(对无机硫化物灵敏)、W1S(对甲烷等短链烷烃灵敏)响应值明显高于其他传感器,W2S(对醇醚醛酮类灵敏)、W2W(对有机硫化物灵敏)、W5S(对氮氧化合物灵敏)次之。上述结果表明发酵糜米液中的无机硫化物、甲烷等短链烷烃、醇醚醛酮类、有机硫化物和氮氧化合物等成分较丰富。
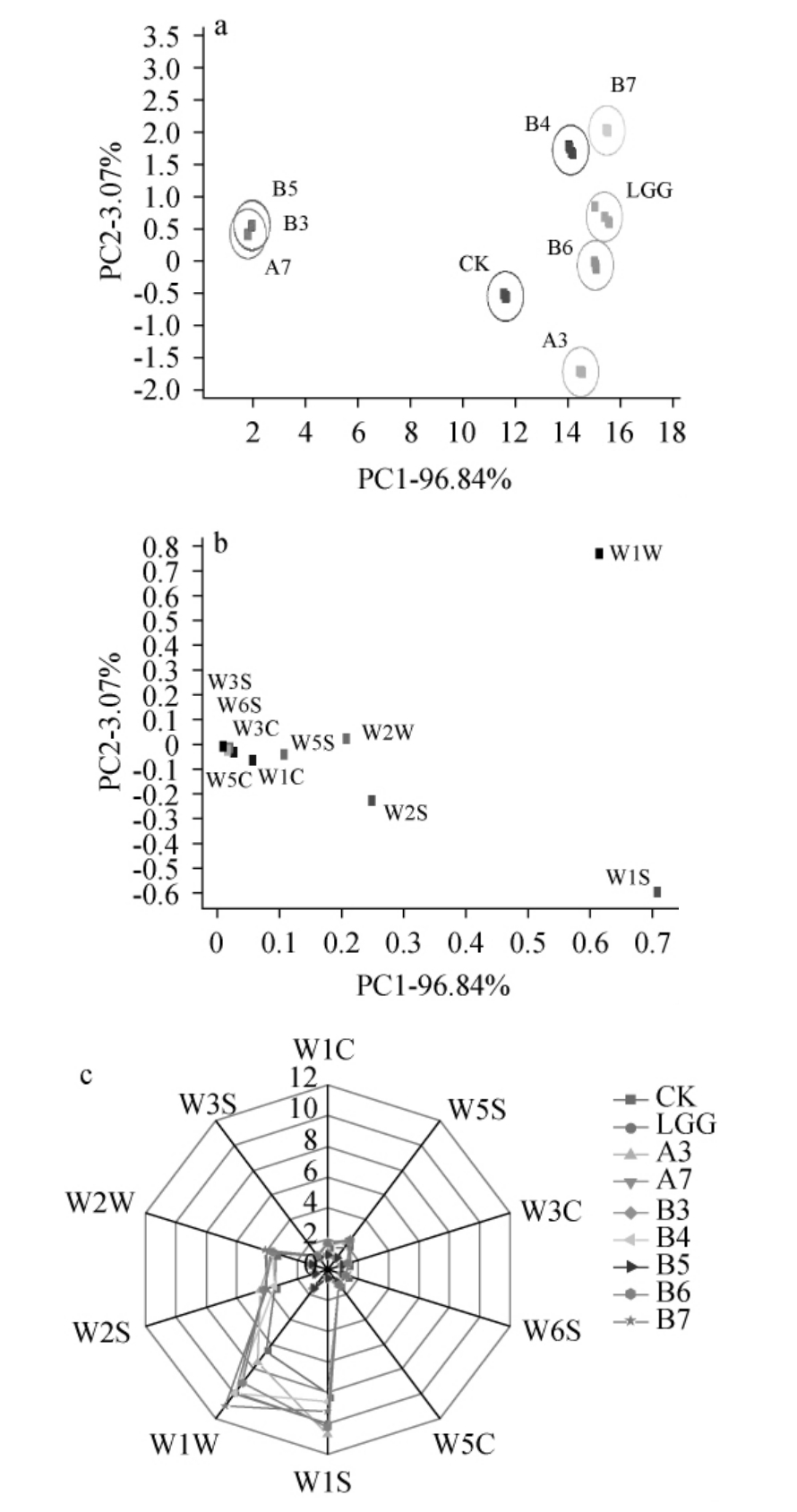
图7 筛选菌株发酵液电子鼻传感器响应值的主成分分析得分图(a)、载荷图(b)及雷达图(c)
Fig.7 Principal component analysis score diagram (a), loading plots(b) and radar map (c) of electronic nose sensor response values of screened strains fermentation broth
3 结论
采用选择性培养法从新疆伊犁地区自然发酵的谷物饮料玛格孜木和波杂中共分离纯化出12株乳酸菌,经16S rDNA序列鉴定分别有7种乳酸菌。生长性能结果表明,波杂中的乳酸菌具有更好的生长能力和产酸能力。筛选乳酸菌对pH 3.5~4.5环境具有耐受能力,对人体无致病力,菌株B7对沙门氏菌抑制能力最强;菌株B7超氧阴离子自由基清除率最高,为53.64%,菌株A3的DPPH自由基清除率、ABTS自由基清除率最高,分别为88.48%和90.91%;筛选乳酸菌均具有降解生淀粉和熟淀粉的优质潜力,波杂来源的乳酸菌生淀粉利用能力更好;电子鼻分析结果显示,7种乳酸菌发酵糜米液的主要的风味贡献物为含硫、短链烷烃化合物、醇类、醛酮类和氮氧化合物。综上,本研究中相较于玛格孜木,波杂中分离的乳酸菌具有更优良的发酵性能。
[1]ZIARNO M,CICHON′SKA P.Lactic acid bacteria-fermentable cereal-and pseudocereal-based beverages[J].Microorganisms,2021,9(12):2532-2556.
[2]AKMAN P K,OZULKU G,TORNUK F,et al.Potential probiotic lactic acid bacteria isolated from fermented gilaburu and shalgam beverages[J].LWT-Food Sci Technol,2021,149:111705.
[3]张悦,汪云阳,周成慧,等.酸粥类食品中乳杆菌的药敏性分析及优势菌株的筛选[J].食品科技,2019,44(9):8-16.
[4]QUEIROZ L L, HOFFMANN C, LACORTE G A, et al.Genomic and functional characterization of bacteriocinogenic lactic acid bacteria isolated from Boza,a traditional cereal-based beverage[J].Sci Rep,2022,12(1):1460-1473.
[5]秦慧彬,黄志伟,张志强,等.传统食品酸粥的发酵工艺[J].食品与发酵工业,2019,45(17):111-116.
[6]JAMILA S,JANYL I,MUKARAMA M.Milk-and cereal-based Kyrgyz ethnic foods[J].Int J Gastronomy Food Sci,2022,29:100507.
[7]ARICI M,DAGLIOGLU O.Boza:A lactic acid fermented cereal beverage as a traditional Turkish food[J].Food Rev Int,2002,18(1):39-48.
[8]张亚明,王德萍,陈钦杰,等.菊粉对速冻熟制拉面品质的影响及塔尔米菊粉拉面的辅助降糖降脂作用[J].食品工业科技,2021,42(1):348-354.
[9]黄晓棠,于宏伟,郭润芳.发酵食品工业中的生物安全性评价[J].食品工业科技,2020,41(4):356-360,367.
[10]陈雨春,王妍,王畅,等.谷物乳酸发酵饮料工艺研究进展[J].食品安全导刊,2020,(33):155-156.
[11]张珣,王婧,丁华,等.DNS法测定茶叶中掺杂蔗糖含量[J].湖北农业科学,2021,60(21):107-111.
[12]高熳熳,焦新雅,张志胜,等.侗族传统发酵酸肉中乳酸菌的筛选、发酵特性及安全性分析[J].食品工业科技,2020,41(12):94-99,105.
[13]韦庆旭,张建鹏,梁煜晨,等.青贮用乳酸菌的分离鉴定及生物学特性评价[J].动物营养学报,2022,34(7):4737-4749.
[14]宋红丽,杨佳夷,郑立,等.抗铜绿假单胞菌南极微生物的筛选、鉴定及其抑菌谱研究[J].中国酿造,2022,41(11):108-112.
[15]张雪静,牛红红,苗欣宇,等.自然发酵玉米液中乳酸菌的分离、鉴定及益生特性研究[J].中国酿造,2023,42(8):129-134.
[16]李颖,刘玉珍,张雨晴,等.具有抗氧化活性的人源乳杆菌菌株筛选[J].食品研究与开发,2019,40(8):199-205.
[17]TONG T,LIU Y J,KANG J,et al.Antioxidant activity and main chemical components of a novel fermented tea[J].Molecules, 2019, 24(16):2917-2931.
[18]KIM N J, JANG H L, YOON K Y.Potato juice fermented with Lactobacillus casei as a probiotic functional beverage[J].Food Sci Biotechnol,2012,21(5):1301-1307.
[19]吴祖芳,洪松虎,沈锡权,等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报,2010,10(1):73-78.
[20] FANG W, XUE S S, DENG P J, et al.AmyZ1: a novel alpha-amylase from marine bacterium Pontibacillus sp.ZY with high activity toward raw starches[J].Biotechnol Biofuels,2019,12(1):95-110.
[21]邴孝凤,何玉,张学成,等.生淀粉水解α-淀粉酶AmyZ1热稳定性提升的分子改造[J].生物学杂志,2023,40(3):35-40.
[22]BANSAL R,KATYAL P.Optimization of α-amylase and glucoamylase production using cull potatoes as substrate[J].Starch Starke,2021,73(9-10):2100105.
[23]张林吉,张海涛,李云龙,等.厨余中产淀粉酶芽孢杆菌的筛选、鉴定及酶学性质研究[J].饲料研究,2021,44(10):69-73.
[24]盛秀丽,马刘峰,方志刚,等.基于电子鼻和HS-SPME-GC-MS技术分析9种新疆石榴果实挥发性成分[J].食品工业科技,2023,44(6):325-334.
[25]ALTAY F,KARBANCIOGLU-GULER F,DASKAYA-DIKMEN C,et al.A review on traditional Turkish fermented non-alcoholic beverages:microbiota, fermentation process and quality characteristics[J].Int J Food Microbiol,2013,167(1):44-56.
[26]冯美琴,龚瑶,孙健.植物乳杆菌和模仿葡萄球菌复配对发酵羊肉香肠理化性质、风味及多肽抗氧化能力的影响[J].食品科学,2024,45(12):116-124.
[27]PENDÓN M D,BENGOA A A,IRAPORDA C,et al.Water kefir:Factors affecting grain growth and health-promoting properties of the fermented beverage[J].J Appl Microbiol,2022,133(1):162-180.
[28]卢宏皓.异/同型发酵乳酸菌对酸笋接种发酵的影响[D].柳州:广西科技大学,2022.
[29]江月.多菌种混合发酵麦芽饮料的研究[D].广州:华南理工大学,2018.
[30]王成.自然发酵酸粥菌群动态分析及其乳酸菌的筛选和应用[D].锦州:锦州医科大学,2021.
[31]张宸瑞,薛桥丽,白彬阳,等.云南牟定酸浆水中优势产酸菌的分离鉴定及生长特性[J].食品科学,2021,42(20):75-82.
[32]唐艳平,张凤琴,郝红梅.贵州白酸汤优势产酸乳酸菌的筛选及发酵性能比较[J].中国食品添加剂,2023,34(10):101-110.
[33]杨小雨,郭晓燕,龙佩霖,等.一株高产淀粉酶乳杆菌的筛选及其安全性评价[J].食品工业科技,2023,44(19):158-166.
[34]单成俊,胡彦新,夏秀东,等.面包乳杆菌(Lactobacillus panis)C-M2细菌素的分离纯化及特性分析[J].食品科学,2017,38(20):20-26.
[35]叶彦均,谭斌,乔聪聪,等.生物发酵对糙米品质影响研究进展[J].食品工业科技,2022,43(10):466-474.
[36]刘庆艾,史建国,马耀宏,等.发酵对粗粮营养价值、抗氧化性以及理化性质的改良研究现状[J].食品工业科技,2016,37(1):363-367.
[37]朱雨柔,季珊珊,吴雨洁,等.煮制对4种谷物淀粉消化性的影响[J].现代食品,2021(15):189-192.