酱油是起源于我国的一种传统调味品,最早可追溯到东汉时期的“酱清”,至今已有近2 000年的酿造历史[1],其已成为人们日常生活中不可或缺的一种发酵调味品。随着经济的发展和人们生活水平的不断提高,对酱油的风味和品质的要求越来越高[2]。在酱油风味研究方面,目前,已有大量研究针对不同类型酱油的挥发性风味物质组成开展研究,并取得了一系列成果[3-4]。近年来,一些学者开始关注酱油风味物质形成机制[5-7],DEVANTHI P V P等[6]提出了酱油风味物质形成的几种主要途径,其中微生物代谢是酱油挥发性风味物质形成的关键途径[8]。已有大量文献开展酱油微生物菌群与风味物质间相关性的研究,以期建立微生物菌群代谢与风味物质形成之间的关系[9-11]。
随着检测技术的进步,酱油中的挥发性风味化合物已检出1 000余种[12],其中酚类化合物是酱油独特风味形成的重要组分,包括苯酚、4-乙基愈创木酚(4-ethylguaiacol,4-EG)、4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)、愈创木酚等[5,13]。4-乙烯基愈创木酚在酱油挥发性风味物质研究中被广泛检出[14-16],呈强烈香辛料、丁香和发酵香气,有炒花生气息,其感官阈值低,为0.3 mg/L[17],是酱油、白酒、葡萄酒和啤酒等发酵食品中的重要风味物质之一,也是这些发酵产品全面风味评价必不可缺的特色成分[5,18]。因此,提高酱油等发酵食品中4-VG的含量可一定程度提升产品感官品质和风味特色。同时,在日化、医药以及香精等行业中,4-VG是不可多得的高档香料,其市场价值约为阿魏酸的40倍左右[19]。基于此,发掘产4-VG的微生物菌株可为酱油等发酵食品风味提升以及高附加值4-VG工业化发酵生产提供重要技术支撑。
4-VG是酱油特征香气成分4-乙基愈创木酚的代谢中间产物,其代谢途径为阿魏酸在阿魏酸脱羧酶的作用下脱去一个羧基形成4-VG,4-VG在4-乙烯基愈创木酚还原酶的催化下还原为4-EG[20]。已有文献报道了多株耐盐酵母可以阿魏酸为底物合成4-EG[20],然而毕赤酵母属(Pichia)、假丝酵母(Candida)、汉逊德巴利酵母(Dabaryomyces hansenii)、木糖葡萄球菌(Staphylococcus xylosus)仅能合成4-VG,不能将其还原为4-EG[21]。合成微生物菌群技术在食品发酵中的应用越来越广泛,即通过多种微生物配伍组合后添加到发酵体系中,已达到改善风味、提升品质、降低成本等目的[22-24]。通过多种微生物组合人为干预酱油发酵风味的研究取得了一系列成果。WU W Y等[25]研究发现,鲁氏接合酵母(Zygosaccharomyces rouxii)和发酵乳杆菌(Lactobacillus fermentium)的组合发酵可增强酱油的酱香、水果香、烟熏味和焦糖样香气的强度,并改善鲜味和浓味;WHA T T等[26]研究发现,假丝酵母与鲁氏酵母共培养产生的醇类、呋喃酮类、酯类、麦芽糖醇类和苯甲酸类物质均高于单一鲁氏酵母培养;SINGRACHA P等[27]研究发现,嗜盐四联球菌(Tetragenococcus halophilus)TS71、鲁氏酵母(Zygosaccharomyces rouxii)A22和季也蒙毕赤酵母(Meyerozyma(Pichia)guilliermondii)EM1Y52组合发酵可提高减盐发酵醪中乙醇、2-甲基-1-丙醇等多种风味物质的含量。因此,从酱油发酵体系中分离筛选可代谢合成特定风味物质微生物,并将其应用于酱油生产,对于提升酱油风味品质有重要意义。
基于此,本研究采用传统培养分离结合嗅闻法从酱油发酵醪中分离筛选可代谢合成4-VG的酵母,并采用形态学观察、生理生化实验及分子生物学技术对其进行菌种鉴定。进一步对其盐耐受性进行分析,并通过阿魏酸添加试验验证筛选菌株合成4-VG的途径。同时,将筛选菌株应用于酱油发酵,并将4-VG含量强化的发酵液添加到酱油成品中,验证4-VG对酱油香气和口感的改善作用。分离筛选可代谢4-VG的酵母,并将其应用于酱油发酵,旨在探讨通过生物强化针对性提升酱油特定风味物质含量的可行性,为工业化生产中定向改善大罐发酵酱油品质提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱油发酵醪:龙牌食品股份有限公司。该发酵醪的原料是大豆和面粉,28~34 ℃制曲后,置于陶缸并加入盐水,采用日晒夜露的传统发酵工艺进行酱醪发酵,取发酵60 d的酱油发酵醪。
成品酱油:龙牌食品股份有限公司的一级生抽酱油。
1.1.2 培养基
13%麦芽汁培养基:广东环凯微生物科技有限公司。
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基[28]:1%酵母浸粉,2%葡萄糖,2%胰蛋白胨,15%NaCl。115 ℃高压蒸汽灭菌15 min。
酱醪发酵液培养基[28]:取发酵14 d的酱油发酵醪,10层纱布过滤,上清液为酱醪发酵液培养基。80 ℃巴氏杀菌45 min。
发酵培养基[28]:10%巴氏杀菌酱油,0.5%酵母浸粉,2%葡萄糖,0.5%胰蛋白胨,15%NaCl。
1.1.3 试剂
麦芽浸粉、胰蛋白胨(均为生化试剂):北京路桥技术股份有限公司;阿魏酸(分析纯)、4-VG(纯度99%)、4-EG(纯度99%):上海阿拉丁生化科技股份有限公司;其他生化试剂均为国产分析纯。
1.2 仪器与设备
Blue Star紫外-可见分光光度计:北京莱伯泰科仪器股份有限公司;7820A-5977B气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;固相微萃取手柄、50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司;HZQ-X300摇床、DHP-9051恒温培养箱:上海一恒科学仪器有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司;DYY-B电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 产香酵母的分离
酱油发酵醪样品用0.85%生理盐水按10倍梯度稀释后涂布于13%麦芽汁培养基平板上,于30 ℃静置培养96 h,挑取单菌落进行进一步划线分离纯化;挑取纯化后的菌株接种于YPD培养基,于30 ℃、200 r/min振荡培养36 h,得到种子液;将种子液按1%(V/V)的接种量分别接种到酱醪发酵液培养基,30 ℃、100 r/min振荡培养13 d,进行香气鉴评,挑选呈酱香发酵液的酵母为目标菌株[29]。
1.3.2 产香酵母发酵液挥发性风味成分分析
以不接种的酱醪发酵液培养基为对照,采用顶空固相微萃取-气相色谱-质谱联用(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPMEGC-MS)技术检测筛选菌株发酵液(实验组)中的挥发性风味成分[29]。
1.3.3 产香酵母的鉴定
形态学观察:将筛选菌株划线接种于13%麦芽汁培养基平板上,30 ℃条件下培养48 h,观察菌落形态;挑起单菌落涂片,并于光学显微镜下观察菌体形态。
生理生化试验:参照《酵母菌的特征与鉴定手册》[30]对筛选菌株进行生理生化试验。
分子生物学鉴定:采用液氮研磨提取筛选菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对菌株的rDNAITS基因序列进行PCR扩增[29]。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托北京六合华大基因科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行rDNA-ITS同源序列检索与分析,选取同源性较高的模式菌株的rDNA-ITS,采用Mega 5.10软件中的邻接法(neighbor-joining,NJ)构建系统发育树[28]。
1.3.4 产香酵母耐盐性能测试
挑取筛选菌株的单菌落接种于YPD培养基,于30 ℃、200 r/min振荡培养36 h,得到种子液;取200 mL种子液4 000 r/min离心10 min,去上清,菌体沉淀采用0.85%生理盐水洗涤2次,再用0.85%生理盐水重悬,并定容至200 mL;将种子液按照5%(V/V)的接种量分别接种于含0%、5%、10%、14%、18%NaCl的13%麦芽汁培养基中,于30 ℃、200 r/min条件下培养96 h,按照一定时间间隔取培养液在波长600 nm处测定吸光度值(OD600nm)[29]。
1.3.5 产香酵母风味前体物代谢能力测试
挑取筛选菌株的单菌落接种于YPD培养基,于30 ℃、200 r/min振荡培养36 h,得到种子液,将种子液按1%(V/V)的接种量分别接种到发酵培养基(对照组)、含有50 mg/L阿魏酸的发酵培养基(实验组),于30 ℃、100 r/min振荡培养11d,对发酵液进行GC-MS分析[29]。
1.3.6 产香酵母在酱油发酵中的应用
将筛选菌株的种子液按照2%(V/V)的接种量接种到酱醪发酵液培养基,添加阿魏酸组加入50 mg/L阿魏酸,对照组加入2%YPD培养基,于30 ℃、100 r/min振荡培养15 d;取发酵液进行理化指标测定[28];同时检测发酵液中4-VG含量[29]。
取高4-VG含量发酵液过滤,并进行巴氏杀菌(70 ℃、30 min);巴氏杀菌的发酵液冷却后按照10%(V/V)添加到成品酱油中(实验组),以未添加的成品酱油为对照组,随机选取8位受到系统培训的品评员按照文献[29]对酱油的香气和滋味进行盲评。
1.3.7 数据处理与分析
所有实验均重复3次,采用SPSS 2019软件处理数据,结果用“平均值±标准差”表示。采用Microsoft Office Excel 2007、OriginPro 8.5进行绘图。
2 结果与分析
2.1 产香酵母的筛选及挥发性风味成分鉴定
从酱油发酵醪样品中分离筛选得到一株产香酵母,编号为L9-1,采用HS-SPME-GC-MS检测菌株L9-1发酵液中的挥发性化合物,结果见图1。由图1可知,实验组检出了乙醇、异丁醇、正丁醇、异戊醇、2,3-丁二醇、苯乙醇、4-乙烯基愈创木酚等多种挥发性化合物,但没有检出4-EG,而对照组只检出了乙醇,且峰面积比实验组小一个数量级,说明菌株L9-1可以在酱醪发酵液培养基中代谢产生乙醇、苯乙醇和异戊醇等醇类物质以及4-VG。推测菌株L9-1缺乏4-VG还原酶,不能将4-VG还原为4-EG[20]。
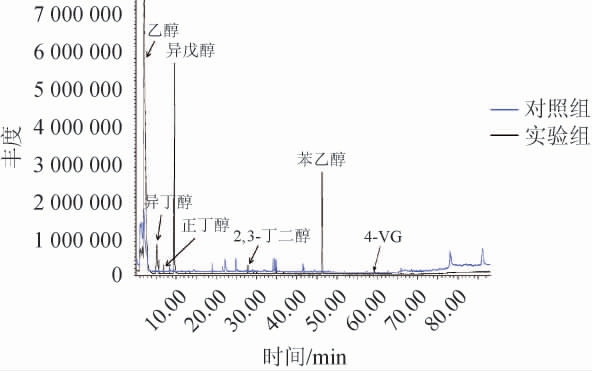
图1 产香酵母L9-1发酵液中挥发性风味成分GC-MS分析总离子流色谱图
Fig.1 Total ion chromatography of volatile flavor components in fermentation broth by aromatic yeast L9-1 analyzed by GC-MS
2.2 产香酵母L9-1的鉴定
2.2.1 形态学鉴定
菌株L9-1在13%麦芽汁培养基平板上的形态特征见图2。由图2a可知,菌株L9-1分生出绒线状菌丝,呈白色,菌丝四周发散延展并向空气中生长,菌丝蓬松。由图2b可知,菌株L9-1呈丝状,菌丝有隔,在菌丝小齿上具有芽分生孢子,菌丝长度为10~60 μm,宽度2~4 μm。根据《酵母菌的特征与鉴定手册》[30]初步推测菌株L9-1为丝孢毕赤酵母属(Hyphopichia sp.)。

图2 产香酵母L9-1的菌落(a)与菌丝(b)形态
Fig.2 Colonial (a) and mycelial (b) morphology of aromatic yeast L9-1
2.2.2 生理生化鉴定
菌株L9-1的生理生化试验结果见表1。由表1可知,菌株L9-1不能发酵阿拉伯糖、木糖等糖类物质,发酵麦芽糖、半乳糖、葡萄糖的能力较弱,发酵蔗糖能力较强,不能同化鼠李糖、阿拉伯糖、乳糖和蜜三糖,但可以同化其他糖类,可同化甘露醇、赤藓醇及水杨苷,能利用可溶性淀粉。此外,菌株L9-1不能同化肌醇、硝酸盐、DL-乳酸和葡萄糖酸盐,在高盐(18%NaCl)和高糖(50%葡萄糖)环境中生长良好,在无维生素培养基中生长较弱,脲酶、1%乙酸测试结果均为阴性;在30 ℃条件下生长较好,在35~37 ℃条件下生长较弱。参照《酵母菌的特征与鉴定手册》[30]初步鉴定菌株L9-1为丝孢毕赤酵母属(Hyphopichia sp.)微生物。
表1 产香酵母L9-1的生理生化实验测试结果
Table 1 Determination results of physiological and biochemical experiments of aromatic yeast L9-1
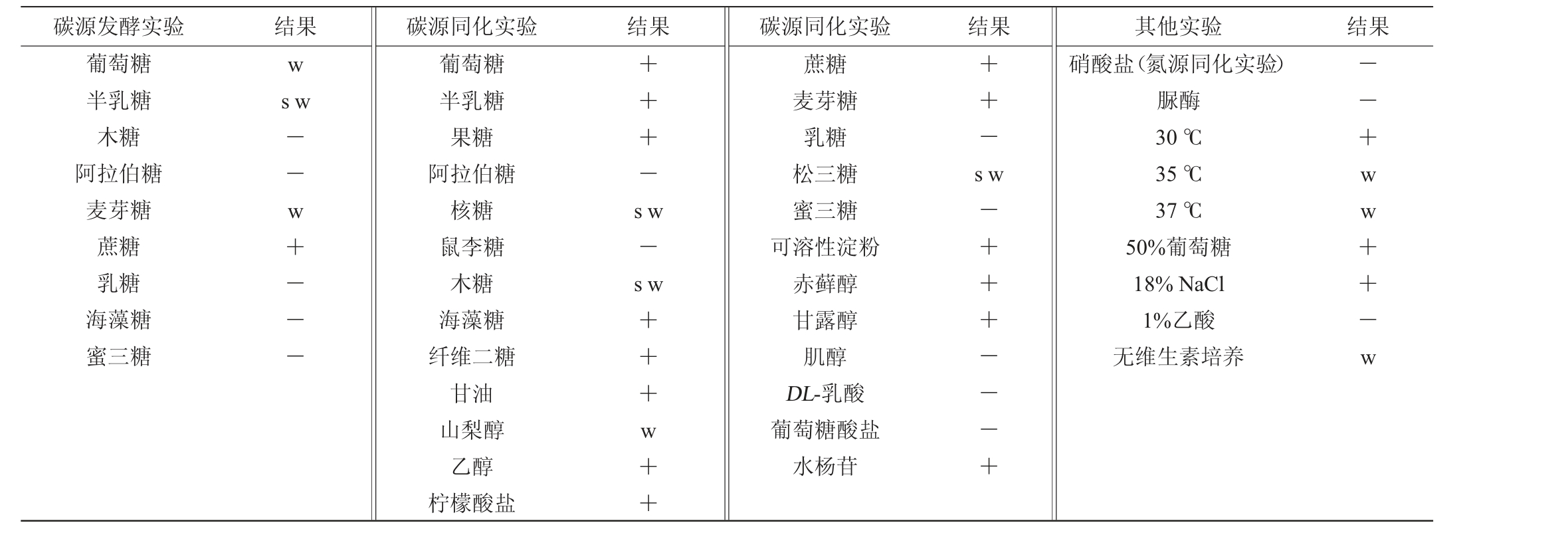
注:“+”表示结果呈阳性;“—”表示结果呈阴性;“s”表示生长缓慢;“w”表示生长微弱。
碳源发酵实验 结果 碳源同化实验 结果 碳源同化实验 结果 其他实验 结果葡萄糖半乳糖木糖阿拉伯糖麦芽糖蔗糖乳糖海藻糖蜜三糖w s w——w+— —葡萄糖半乳糖果糖阿拉伯糖核糖鼠李糖木糖海藻糖纤维二糖甘油山梨醇乙醇柠檬酸盐+++—++—s w s w—s w+++w++蔗糖麦芽糖乳糖松三糖蜜三糖可溶性淀粉赤藓醇甘露醇肌醇DL-乳酸葡萄糖酸盐水杨苷—+++— —+硝酸盐(氮源同化实验)脲酶30 ℃35 ℃37 ℃50%葡萄糖18%NaCl 1%乙酸无维生素培养——+ww++—w
2.2.3 分子生物学鉴定
基于rDNA-ITS基因序列构建产香酵母L9-1的系统发育树,结果见图3。
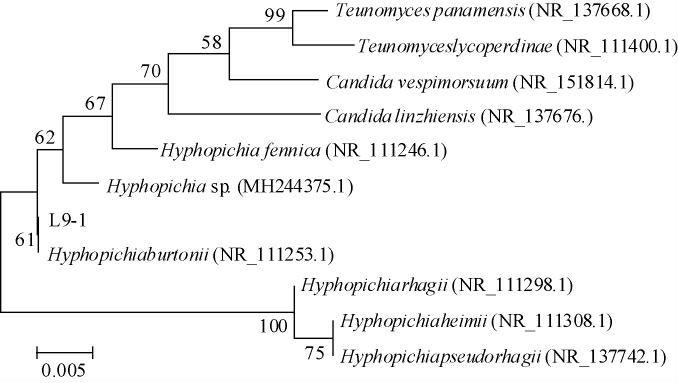
图3 基于rDNA-ITS基因序列菌株L9-1的系统发育树
Fig.3 Phylogenetic tree of strain L9-1 based on rDNA-ITS gene sequence
由图3可知,菌株L9-1与伯顿丝孢毕赤酵母(Hyphopichia burtonii)聚为一支,亲缘关系最近,rDNA-ITS序列同源性达到99.76%。综合菌落和菌体形态学观察、生理生化实验结果,最终鉴定菌株L9-1为伯顿丝孢毕赤酵母(H.burtonii)。LI W W等[31]研究发现,在大曲中添加H.burtonii F12507等酵母可改变酒醪真菌菌群结构并提高发酵过程中己酸乙酯的含量。XU X X等[32]研究发现,在红辣椒发酵过程中,Hyphopichia是高丰度菌群之一,并与11种重要风味物质的形成呈正相关。虽然酱油微生物菌群研究中关于H.burtonii的报道较少,但预测其对酱油风味物质的形成有重要贡献。
2.3 产香酵母L9-1的耐盐性分析
产香酵母L9-1的耐盐性分析结果见图4。由图4可知,随着NaCl含量在0~18%范围内的升高,菌株L9-1对数期生长增殖速度逐渐下降,但菌株L9-1均能生长,说明菌株L9-1具有较好的耐盐能力,具备在含18%NaCl的酱油发酵醪中生长的能力,但是其细胞增殖速率和稳定期细胞浓度受到一定抑制。
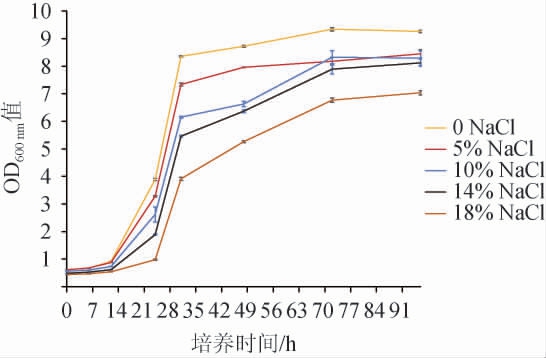
图4 伯顿丝孢毕赤酵母L9-1耐盐性试验结果
Fig.4 Results of Hyphopichia burtonii L9-1 salt tolerance experiments
2.4 产香酵母L9-1风味前体物代谢能力分析
对H.burtonii L9-1合成4-VG的代谢途径进行研究,结果表明,实验组(添加50 mg/L阿魏酸,接种H.burtonii L9-1)检出了大量的4-VG,其含量达到了24.36 mg/L,但未检出4-EG,对照组中4-EG、4-VG均未检出。结果表明,H.burtonii L9-1可以以阿魏酸为底物合成4-VG,但是可能缺失4-VG还原酶,不能进一步将4-VG还原为4-EG。在4-EG代谢真菌研究方面,仅能将阿魏酸脱羧为4-VG,不能将4-VG还原为4-EG的微生物鲜有报道。H.burtonii L9-1的分离为高盐发酵食品中定向提高4-VG含量提供了菌种资源。
2.5 产香酵母在酱油发酵中的应用
将H. burtonii L9-1接种到酱醪发酵液培养基(添加/不添加阿魏酸)发酵15 d,测定发酵液的理化指标,结果见表2。
表2 伯顿丝孢毕赤酵母L9-1添加对酱醪发酵液理化指标的影响
Table 2 Effects of addition of Hyphopichia burtonii L9-1 on physicochemical indexes of sauce mash fermented broth

注:同列间不同字母表示差异显著(P<0.05)。
组别 总酸含量/(g·100 mL-1)氨基酸态氮含量/(g·100 mL-1) pH值 盐分/(g·100 mL-1)还原糖含量/(g·100 mL-1)酱醪发酵液培养基+2%YPD培养基(接种)酱醪发酵液培养基+2%YPD培养基(未接种)酱醪发酵液培养基+50 mg/L阿魏酸(接种)酱醪发酵液培养基+50 mg/L阿魏酸(未接种)1.33±0.19a 5.61±0.11b 1.29±0.10a 5.56±0.16b 1.52±0.03a 1.46±0.03b 1.56±0.02a 1.47±0.05ab 0.83±0.04a 0.85±0.02a 0.84±0.03a 0.87±0.04a 4.63±0.04a 4.84±0.08b 4.61±0.02a 4.87±0.07b 16.53±0.10a 16.67±0.11a 16.50±0.04a 16.72±0.15a
由表2可知,在不添加阿魏酸的情况下,接种H.burtonii L9-1可显著提高发酵液的总酸含量(提高0.06 g/100 mL)(P<0.05),显著降低pH(下降0.21)、还原糖含量(下降4.28 g/100 mL)(P<0.05),氨基酸态氮和盐分含量变化不显著(P>0.05);推测H.burtonii L9-1可利用酱醪发酵液中的葡萄糖进行代谢,并转化产生了一定含量的酸类物质。由表2亦可知,添加阿魏酸的情况与上述结果接近,接种H.burtonii L9-1可提高总酸含量(P>0.05),显著降低pH、还原糖含量(P<0.05),氨基酸态氮和盐分含量变化不显著(P>0.05)。结果表明,H.burtonii L9-1可以在酱醪发酵液中正常利用葡萄糖进行生长代谢,对酱醪氨基酸态氮和盐分指标影响不显著,但可提高发酵液总酸含量,降低pH和还原糖含量;添加底物不影响H.burtonii L9-1的还原糖和有机酸代谢,也不干扰体系氨基酸的形成。
采用GC-MS检测4种发酵液中的4-VG含量,结果发现,未接种酱醪发酵液培养基中均未检出4-VG,接种H.burtonii L9-1发酵的酱醪发酵液培养基中4-VG含量为0.47 mg/L,添加50 mg/L阿魏酸并接种H.burtonii L9-1发酵的酱醪发酵液培养基中4-VG含量17.01 mg/L,结果进一步说明,H.burtonii L9-1在酱油发酵体系中具有合成代谢4-VG的能力,且添加阿魏酸后4-VG的含量显著提升(P<0.05)。
将添加50 mg/L阿魏酸并接种H.burtonii L9-1发酵的酱醪发酵液调配到成品酱油中,并对成品进行感官评价,结果见图5。

图5 接种Hyphopichia burtonii L9-1发酵得到的高4-乙烯基愈创木酚含量酱醪发酵液对酱油香气(a)和滋味(b)的影响
Fig.5 Effect of inoculation of sauce mash fermentation broth with high 4-vinylguaiacol content fermented by Hyphopichia burtonii L9-1 on flavor (a) and taste (b) of soy sauce
由图5可知,在香气方面,高4-VG含量酱醪发酵液的添加可在一定程度上提升成品酱油的综合香气、焦香和醇香,改善酱香,提高鉴评人员的偏好程度;在口感方面,高4-VG含量酱醪发酵液的添加可在一定程度上提升酱油综合口感和厚味并减弱咸味,同时可提升鉴评人员的偏好程度;以上感官评价结果与4-乙基愈创木酚对酱油感官特性改善的效果相近[29]。结果表明,H.burtonii L9-1在酱油生物强化提高风味物质4-VG含量和改善酱油品质方面具有应用前景。
3 结论
从酱油发酵醪中分离筛选得到1株可产4-VG的酵母菌株L9-1,采用形态学、生理生化实验和分子生物学技术鉴定其为伯顿丝孢毕赤酵母(Hyphopichia burtonii)。H.burtonii L9-1可耐受18% NaCl,能够在酱醪发酵液中正常生长代谢,并合成4-乙烯基愈创木酚。H.burtonii L9-1接种至添加有50 mg/L阿魏酸的酱醪发酵液中,可将4-VG的含量提高36.2倍,可提高酱醪发酵液总酸含量(P>0.05),显著降低pH和还原糖含量(P<0.05),但对氨基酸态氮和盐分影响不显著(P>0.05)。在成品酱油中添加高4-VG含量的酱醪发酵液,可显著改善成品酱油的综合香气、酱香、焦香的醇香,并一定程度提升酱油综合口感和厚味并缓和咸味。结果表明,分离筛选到的菌株H.burtonii L9-1可利用酱油本底物质合成4-VG,并改善酱油香气和口感。在现代化大规模、短周期酱油发酵模式下,酱油特征风味物质含量普遍较低,利用生物强化技术针对性提高特定风味物质含量对于改善酱油品质有重要意义。
[1]于林,陈义伦,吴澎,等.我国史籍记载的酱及酱油历史起源研究[J].山东农业大学学报:社会科学版,2015,17(1):14-17.
[2]张智宏,陈嘉琳,黄鑫,等.酱油的历史及原酿造酱油发展趋势[J].现代食品科技,2023,39(12):302-309.
[3]WANG X J,GUO M Y,SONG H L,et al.Characterization of key odoractive compounds in commercial high-salt liquid-state soy sauce by switchable GC/GC×GC-olfactometry-MS and sensory evaluation[J].Food Chem,2021,342:128224.
[4]ZHAO G, DING L L, HADIATULLAH H, et al.Characterization of the typical fragrant compounds in traditional Chinese-type soy sauce[J].Food Chem,2020,312:126054.
[5]DIEZ-SIMON C,EICHELSHEIM C,MUMM R,et al.Chemical and sensory characteristics of soy sauce:A review[J].J Agr Food Chem,2020,68(42):11612-11630.
[6]DEVANTHI P V P,GKATZIONIS K.Soy sauce fermentation:Microorganisms, aroma formation, and process modification[J].Food Res Int,2019,120:364-374.
[7]GAO X L,ZHAO X,HU F,et al.The latest advances on soy sauce research in the past decade:Emphasis on the advances in China[J].Food Res Int,2023,8:113407.
[8]O'TOOLE D K.The role of microorganisms in soy sauce production[J].Adv Appl Microbiol,2019,108:45-113.
[9]YAN Y H,ZHANG M,ZHANG Y C,et al.Correlation between bacterial diversity and flavor substances in Longgang soy sauce[J].Biosci Biotech Bioch,2023,87(5):541-554.
[10]LIU X Y,BAI W D,ZHAO W H,et al.Correlation analysis of microbial communities and precursor substances of ethyl carbamate (EC) during soy sauce fermentation[J].LWT-Food Sci Technol,2021,152:112288.
[11]TAN G L, HU M, LI X L, et al.Microbial community and metabolite dynamics during soy sauce koji making[J].Front Microbiol,2022,13:841529.
[12]冯云子,周婷,吴伟宇,等.酱油风味与功能性成分研究进展[J].食品科学技术学报,2021,39(4):14-28.
[13]ZHANG Y F,TAO W Y.Flavor and taste compounds analysis in Chinese solid fermented soy sauce[J].Afr J Biotechnol,2009,8(4):673-681.
[14]SUN S Y,JIANG W G,ZHAO Y P.Profile of volatile compounds in 12 Chinese soy sauces produced by a high-salt-diluted state fermentation[J].J I Brewing,2010,116(3):316-328.
[15]GAO X L,FENG T,SHENG M J,et al.Characterization of the aromaactive compounds in black soybean sauce, a distinctive soy sauce[J].Food Chem,2021,364:130334.
[16]QI Q,HUANG J,ZHOU R Q,et al.Characterizing microbial community and metabolites of Cantonese soy sauce[J].Food Biosci,2021,40:100872.
[17]巩园园,毛豪,晋湘宜,等.产4-乙烯基愈创木酚细菌的筛选及酚酸脱羧酶基因的克隆与表达[J].中国酿造,2021,40(7):160-164.
[18]李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-19.
[19]TANRUEAN K, RAKARIYATHAM N.Efficient synthesis of 4-vinyl guaiacol via bioconversionof ferulic acid by Volvariella volvacea[J].Chiang Mai J Sci,2016,43(1):158-168.
[20]SUEZAWA Y, SUZUKI M.Bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol and of 4-vinylguaiacol to 4-ethylguaiacol by halotolerant yeasts belonging to the genus Candida[J].Biosci Biotech Bioch,2007,71(4):1058-1062.
[21]SUTHERLAND J B,TANNER L A,MOORE J D,et al.Conversion of ferulic acid to 4-vinylguaiacol by yeasts isolated from frozen concentrated orange juice[J].J Food Protect,1995,58(11):1260-1262.
[22]WANG S L,WU Q,NIE Y,et al.Construction of synthetic microbiota for reproducible flavor compound metabolism in Chinese light-aroma-type liquor produced by solid-state fermentation[J].Appl Environ Microbiol,2019,85(10):e03090-18.
[23]CHEN L Q, WANG G Z, TENG M J, et al.Non-gene-editing microbiome engineering of spontaneous food fermentation microbiota—limitation control,design control,and integration[J].Compr Rev Food Sci Food Safety,2023,22(3):1902-1932.
[24]JIA Y,NIU C T,LU Z M,et al.A bottom-up approach to develop a synthetic microbial community model: Application for efficient reducedsalt broad bean paste fermentation[J].Appl Environ Microbiol,2020,86(12):e00306-20.
[25]WU W Y,CHEN T,ZHAO M M,et al.Effect of co-inoculation of different halophilic bacteria and yeast on the flavor of fermented soy sauce[J].Food Biosci,2023,51:102292.
[26]WAH T T,WALAISRI S,ASSAVANIG A,et al.Co-culturing of Pichia guilliermondii enhanced volatile flavor compound formation by Zygosaccharomyces rouxii in the model system of Thai soy sauce fermentation[J].Int J Food Microbiol,2013,160(3):282-289.
[27]SINGRACHA P,NIAMSIRI N,VISESSANGUAN W,et al.Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J].LWT-Food Sci Technol, 2017, 78:181-188.
[28]邹谋勇,朱新贵,孙启星,等.一株产2-苯乙醇酵母的鉴定及其在酱油酿造中的应用[J].中国酿造,2020,39(5):173-178.
[29]邹谋勇,何理琴,孙启星,等.产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用[J].食品科学,2021,42(12):138-144.
[30]巴尔特J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:132-135.
[31]LI W W,FAN G S,FU Z L,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Res Int,2020,129:108837.
[32]XU X X,WU B B,ZHAO W T,et al.Shifts in autochthonous microbial diversity and volatile metabolites during the fermentation of chili pepper(Capsicum frutescens L.)[J].Food Chem,2021,335:127512.